题目内容
5.A、B、C、D是四种短周期元素,E是过渡元素,A、B、C同周期,C、D是同主族,A的原子结构示意图为 ,B是同周期第一电离能最小的元素,C的最外层有三个未成对电子,E的外围电子排布式为3d64s2.回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个未成对电子,E的外围电子排布式为3d64s2.回答下列问题:(1)写出下列元素的符号:ASi、EFe.
(2)上述五种元素中最高价氧化物对应的水化物中酸性最强的是HNO3.(填写化学式)
(3)已知元素周期表可按电子排布分为s区、p区、d区、ds区等,则E元素在d区.
(4)画出D的价电子排布图
 ,这样排布遵循了能量最低、泡利原理和洪特规则.
,这样排布遵循了能量最低、泡利原理和洪特规则.(5)用电子式表示B的硫化物的形成过程
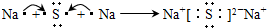 .
.
分析 A、B、C、D是四种短周期元素,由A的原子结构示意图可知,x=2,A的原子序数为14,故A为Si元素;A、B、C同周期,B是同周期第一电离能最小的元素,故B为Na元素,C的最外层有三个成单电子,故C原子的3p能级有3个电子,故C为P元素;C、D同主族,故D为N元素;E是过渡元素,E的外围电子排布式为3d64s2,E的核外电子排布式为1s22s22p63s23p63d64s2,则E为Fe元素,以此解答该题.
解答 解:A、B、C、D是四种短周期元素,由A的原子结构示意图可知,x=2,A的原子序数为14,故A为Si元素;A、B、C同周期,B是同周期第一电离能最小的元素,故B为Na元素,C的最外层有三个成单电子,故C原子的3p能级有3个电子,故C为P元素;C、D同主族,故D为N元素;E是过渡元素,E的外围电子排布式为3d64s2,E的核外电子排布式为1s22s22p63s23p63d64s2,则E为Fe元素.
(1)由以上分析可知A为Si,E为Fe,故答案为:Si;Fe;
(2)非金属性N>P>Si,则酸性最强的最高价氧化物对应的水化物为硝酸,即HNO3,故答案为:HNO3;
(3)E为Fe元素,E的核外电子排布式为1s22s22p63s23p63d64s2,故核电荷数是26,Fe在周期表中处于第四周期第Ⅷ族,在周期表中处于d 区,
故答案为:d;
(4)D是N元素,原子核外有7个电子,1s、2s、2p能级上分别排列2、2、3个电子,所以其核外电子排布图为: ,这样排布遵循了能量最低原理、泡利不相容原理、洪特规则,
,这样排布遵循了能量最低原理、泡利不相容原理、洪特规则,
故答案为: ;能量最低、泡利;洪特;
;能量最低、泡利;洪特;
(5)B是钠元素,钠最外层有1个电子,易失去电子而达到稳定结构,硫原子核外有6个电子,易得到2个电子达到稳定结构,所以硫化钠的形成过程为: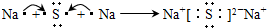 ,故答案为:
,故答案为: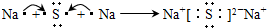 .
.
点评 本题考查元素推断、元素周期律、核外电子排布规律、常用化学用语等,难度不大,推断元素是解题的关键,注意熟练掌握元素周期律与物质性质的递变规律.

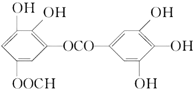 某有机物的结构简式是(如图),下列关于它的性质叙述正确的是( )
某有机物的结构简式是(如图),下列关于它的性质叙述正确的是( )①能发生加成反应
②能溶解于NaOH溶液
③能水解生成两种酸
④不能因发生加成反应而使溴水褪色
⑤能发生酯化反应
⑥有酸性.
| A. | ①②③ | B. | ②③⑤ | C. | ⑥ | D. | 全部正确 |
| A. | 该产物的名称是1,1-二甲基丙烷 | |
| B. | 1mol加成产物燃烧消耗6.5mol氧气 | |
| C. | 原单烯烃只可能有3种不同结构 | |
| D. | 原烯烃与分子式是C3H6的烃一定互为同系物 |
| A. | 第四周期ⅤB族 | B. | 第四周期ⅡB组 | C. | 第四周期ⅦA族 | D. | 第四周期ⅦB族 |
| A. | 晶体熔点由低到高:F2<Cl2<Br2<I2 | |
| B. | 熔点由高到低:Rb>K>Na | |
| C. | 硬度由大到小:金刚石>碳化硅>晶体硅 | |
| D. | 晶格能由大到小:NaF>NaCl>NaBr>NaI |
| 选项 | 实验事实 | 理论解释 |
| A | HCl气体溶于水,能导电 | HCl为离子化合物 |
| B | HBr的酸性强于HCl的酸性 | Br的非金属性比Cl强 |
| C | K3C60在熔融状态下能够导电 | K3C60中含有离子键 |
| D | HF的沸点高于HCl | HF分子间形成有氢键 |
| A. | A | B. | B | C. | C | D. | D |
| A. | PH4I加热易分解,且可产生紫红色气体 | |
| B. | PH4I很稳定,加热不易分解 | |
| C. | PH4I不能与NaOH反应 | |
| D. | PH4I不能由PH3与HI化合生成 |
| A. | 混合气体的密度恒定不变 | B. | 混合气体的颜色不再改变 | ||
| C. | H2、I2、HI的浓度相等 | D. | 气体总物质的量不变 |
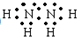 ,过氧化氢的结构式:
,过氧化氢的结构式: .
.