题目内容
19.在A、B、C、D、E五种短周期主族元素中,A、B、C三种元素的原子序数依次增大,A、C都能与B按原子个数比为1:1或2:1形成化合物,但常温时A、B形成的化合物呈液态,C、B形成的化合物呈固态.D的原子最外层电子数最多,E的核电荷数最大,D与E能形成气态物质ED4.(1)画出D的原子结构简图
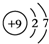 ,五种元素原子半径从大到小的顺序是Na、Si、O、F、H(填元素符号);
,五种元素原子半径从大到小的顺序是Na、Si、O、F、H(填元素符号);(2)A与B形成的化合物中,含非极性键的化合物的结构式为H-O-O-H;
(3)C与B按原子个数比为1:1形成化合物的电子式是
 ,ED4的电子式是
,ED4的电子式是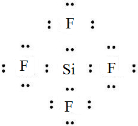 ;
;(4)D、E所形成氢化物的稳定性由强到弱的顺序是HF>SiH4(填具体的化学式).
分析 A、B、C、D、E五种短周期主族元素中,A、B、C三种元素的原子序数依次增大,A、C都能与B按原子个数比为1:1或2:1形成的化合物,则A为H元素、B为氧元素、C为Na元素;D与E能形成气态物质ED4,则E为+4价,D为-1价,E的核电荷数最大,则E为Si元素、D为F元素,据此解答.
解答 解:A、B、C、D、E五种短周期主族元素中,A、B、C三种元素的原子序数依次增大,A、C都能与B按原子个数比为1:1或2:1形成的化合物,则A为H元素、B为氧元素、C为Na元素;D与E能形成气态物质ED4,则E为+4价,D为-1价,E的核电荷数最大,则E为Si元素、D为F元素,
(1)D为F元素,原子结构示意图为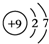 ,同周期自左而右原子半径减小,故原子半径Na>Si,O>F,H原子半径最小,结合同主族自上而下原子半径增大,故原子半径从大到小的顺序是Na、Si、O、F、H,
,同周期自左而右原子半径减小,故原子半径Na>Si,O>F,H原子半径最小,结合同主族自上而下原子半径增大,故原子半径从大到小的顺序是Na、Si、O、F、H,
故答案为: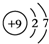 ;Na、Si、O、F、H;
;Na、Si、O、F、H;
(2)H与O形成的化合物中,含非极性键的化合物为H2O2,其结构式为H-O-O-H,故答案为:H-O-O-H;
(3)Na与O按原子个数比为1:1形成化合物为Na2O2,其电子式是 ,ED4的电子式是
,ED4的电子式是
故答案为: ;
; ;
;
(4)非金属性F>Si,故成氢化物的稳定性由强到弱的顺序是HF>SiH4,故答案为:HF>SiH4.
点评 本题考查原子结构与元素周期率的关系、元素及其化合物的性质、常用化学用语等,难度中等,熟练掌握常见元素化合物推断元素是解题关键.

练习册系列答案
相关题目
9.卤代烃Y的相对分子质量为92.5,取0.1molY与足量NaOH溶液共热后,再稀HNO3酸化,加入足量AgNO3溶液,得白色沉淀14.35g,则Y与NaOH的乙醇溶液共热,反应后生成的不饱和烃有( )种.
| A. | 5种 | B. | 4种 | C. | 3种 | D. | 2种 |
10.下列对一些实验事实和理论解释正确的是( )
| 选项 | 实验事实 | 理论解释 |
| A | HCl气体溶于水,能导电 | HCl为离子化合物 |
| B | HBr的酸性强于HCl的酸性 | Br的非金属性比Cl强 |
| C | K3C60在熔融状态下能够导电 | K3C60中含有离子键 |
| D | HF的沸点高于HCl | HF分子间形成有氢键 |
| A. | A | B. | B | C. | C | D. | D |
14.恒容密闭容器中的可逆反应H2(g)+I2(g)?2HI(g),达到反应限度时的标志是( )
| A. | 混合气体的密度恒定不变 | B. | 混合气体的颜色不再改变 | ||
| C. | H2、I2、HI的浓度相等 | D. | 气体总物质的量不变 |
4.如图所示装置,将溶液A逐滴加入固体B中,下列叙述中不正确的是( )


| A. | 若a为浓盐酸,b为MnO2,c中盛品红溶液,则c中溶液褪色 | |
| B. | 若a为醋酸溶液,b为贝壳,c中盛过量澄清石灰水,则c中溶液变浑浊 | |
| C. | 若a为浓硫酸,b为Na2SO3固体,c中盛紫色石蕊溶液,则c中溶液变红 | |
| D. | 若a为浓氨水,b为生石灰,c中盛AlCl3溶液,则c中产生白色沉淀 |
11.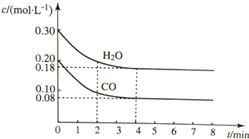 在容积为10L的容器中,通入一定量的CO和H2O(g),在850℃时发生反应CO(g)+H2O?CO2(g)+H2(g)△H<0.CO和H2O浓度变化如图所示.
在容积为10L的容器中,通入一定量的CO和H2O(g),在850℃时发生反应CO(g)+H2O?CO2(g)+H2(g)△H<0.CO和H2O浓度变化如图所示.
(1)则0~4min内反应速率v(CO)为0.03mol/(L•min);
(2)1000℃时,在相同容器中发生上述反应,容器内各物质的浓度变化如下表.
1000℃时物质浓度的变化
①c1数值>0.08mol/L(填“<”“>”或“=”);
②表中5~6min之间数值发生变化,可能的原因是a(填字母).
a.增加水蒸气
b.降低温度
c.使用催化剂
d.增加氢气浓度.
 在容积为10L的容器中,通入一定量的CO和H2O(g),在850℃时发生反应CO(g)+H2O?CO2(g)+H2(g)△H<0.CO和H2O浓度变化如图所示.
在容积为10L的容器中,通入一定量的CO和H2O(g),在850℃时发生反应CO(g)+H2O?CO2(g)+H2(g)△H<0.CO和H2O浓度变化如图所示.(1)则0~4min内反应速率v(CO)为0.03mol/(L•min);
(2)1000℃时,在相同容器中发生上述反应,容器内各物质的浓度变化如下表.
1000℃时物质浓度的变化
| t/min | c(CO)/(mol•L-1) | c(H2O)/(mol•L-1) | c(CO2)/(mol•L-1) | c(H2)/(mol•L-1) |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 1 | 0.138 | 0.238 | 0.062 | 0.062 |
| 2 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
| 5 | 0.116 | 0.216 | 0.084 | 0.084 |
| 6 | 0.096 | 0.266 | 0.104 | 0.104 |
②表中5~6min之间数值发生变化,可能的原因是a(填字母).
a.增加水蒸气
b.降低温度
c.使用催化剂
d.增加氢气浓度.
9.下列物质中属于含有共价键的离子化合物的是( )
| A. | NaOH | B. | AlCl3 | C. | K2S | D. | Cl2 |

 .
.
 ,
, ,
, .
. .
.