题目内容
1. “低碳生活”不只是一种理想,更是一种值得期待的新的生活方式.
“低碳生活”不只是一种理想,更是一种值得期待的新的生活方式.(1)将CO2与焦炭作用生成CO,CO可用于炼铁等.
①已知:Fe2O3(s)+3C(石墨)═2Fe(s)+3CO(g)△H1=+489.0kJ/mol
C(石墨)+CO2(g)═2CO(g)△H2=+172.5kJ/mol;则CO还原Fe2O3的热化学方程式为Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5kJ•mol-1;
②氯化钯(PdCl2)溶液常被应用于检测空气中微量CO.PdCl2被还原成单质,反应的化学方程式为PdCl2+CO+H2O=Pd+CO2+2HCl;
(2)将两个石墨电极插入KOH溶液中,向两极分别通入C3H8和O2,构成丙烷燃料电池.
①负极电极反应式是:C3H8 +26OH--20e-=3CO32-+17H2O;
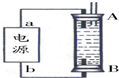
②某同学利用丙烷燃料电池设计了一种电解法制取Fe(OH)2的实验装置(如图所示),通电后,溶液中产生大量的白色沉淀,且较长时间不变色.下列说法中正确的是ABD(填序号)
A.电源中的a一定为正极,b一定为负极
B.可以用NaCl溶液作为电解液
C.A、B两端都必须用铁作电极
D.阴极发生的反应是:2H++2e-=H2↑
(3)在一定温度下,氧化铁可以与一氧化碳发生反应:Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g).已知该反应在不同温度下的平衡常数如表:
| 温度/℃ | 1000 | 1150 | 1300 |
| 平衡常数 | 64.0 | 50.7 | 42.9 |
②在一个容积为10L的密闭容器中,1 000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过10min后达到平衡.求该时间范围内反应的平均反应速率v(CO2)=0.006mol•L-1,CO的平衡转化率为60%.
③欲提高②中CO的平衡转化率,可采取的措施是C.
A.减少Fe的量 B.增加Fe2O3的量 C.移出部分CO2 D.提高反应温度 E.减小容器的容积 F.加入合适的催化剂
(4)将2.4g碳在足量氧气中燃烧,所得气体通入100mL 3.0mol/L的氢氧化钠溶液中,完全吸收后,溶液中所含离子的物质的量浓度由大到小的顺序为c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+).
分析 (1)①依据热化学方程式和盖斯定律计算得到所需热化学方程式;②根据氧化还原反应规律,CO与PdCl2溶液反应,PdCl2被还原成单质,则CO被氧化成CO2,根据质量守恒定律,有水参与反应同时生成氯化氢,据此写出反应的化学方程式即可;
(2)①根据C3H8和O2构成丙烷燃料电池的总反应:C3H8+5O2+6OH-=3CO32-+7H2O,正极发生还原反应,电极反应式为:O2+4e-+2H2O=4OH-,而负极电极反应式=总反应方程式-正极的电极反应式来解答;
②A、B端析出氢气可驱赶原溶液中溶解的少量氧气;B、电解液选用NaCl溶液不影响实验,因为阳极是铁失电子生成亚铁离子,溶液中的阴离子不放电; C、阳极应该用铁电极,阴极用惰性电极亦可; D、B电极反应是阴极氢离子放电生成氢气;
(3)①平衡常数为生成物的浓度幂之积除以反应物的浓度幂之积;图表数据分析,随温度升高平衡常数减小;
②依据化学平衡三段式列式计算,令平衡时CO的物质的量变化为nmol,利用三段式表示出平衡时CO、CO2的物质的量,化学计量数都是1,利用物质的量代替浓度代入平衡常数计算n的值,进而计算CO的浓度变化量,反应速率v=$\frac{△c}{△t}$,转化率=$\frac{消耗量}{起始量}$×100%;
③提高CO的平衡转化率,应使平衡向正反应移动,但不能增大CO的用量,结合选项根据平衡移动原理分析;
(4)2.4g碳是0.2mol,燃烧生成0.2molCO2,与0.3molNaOH反应的化学方程式为:2CO2+3NaOH=NaHCO3+Na2CO3+H2O,生成0.1molNa2CO3、0.1molNaHCO3,在含等物质的量的碳酸钠、碳酸氢钠的溶液中,碳酸根离子水解大于碳酸氢根离子的水解,水解使溶液显碱性,以此来解答.
解答 解:(1)①Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)△H1=+489.0kJ•mol-1
②C(石墨)+CO2(g)=2CO(g)△H2=+172.5kJ•mol-1
由盖斯定律①-②×3得到:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5 kJ•mol-1,
故答案为:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5 kJ•mol-1;
②氧化还原反应规律,CO与PdCl2溶液反应,PdCl2被还原成单质,则CO被氧化成CO2,根据质量守恒定律,有水参与反应同时生成氯化氢,反应的化学方程式为:PdCl2+CO+H2O=Pd+CO2+2HCl,故答案为:PdCl2+CO+H2O=Pd+CO2+2HCl;
(2)C3H8和O2构成丙烷燃料电池的总反应:C3H8+5O2+6OH-=3CO32-+7H2O,正极发生还原反应,电极反应式为:O2+4e-+2H2O=4OH-,负极发生氧化反应,电极反应式为:C3H8 +26OH--20e-=3CO32-+17H2O;故答案为:C3H8 +26OH--20e-=3CO32-+17H2O;
②A、因为生成的氢气将装置中原有氧气溢出,所以氢气从B端阴极析出,A电极则是铁做阳极失去电子生成亚铁离子,电源中的a与A相连,则a为正极,b与B相连,则b为负极,故A正确;
B、电解池中阳极是铁失去电子发生氧化反应生成亚铁离子,阴极是溶液中的氢离子得电子发生还原反应,所以电解质溶液中的阴离子不会在阳极失电子,所以选用NaCl溶液不影响实验,故B正确;
C、阳极应该用铁电极,阴极可以是铁也可以是其他惰性电极,故C错误;
D、阴极氢离子放电,其电极反应为2H++2e-=H2↑,故D正确;
故选:ABD;
(3)①因平衡常数等于生成物浓度幂之积除以反应物浓度幂之积,则K=$\frac{{c}^{3}(C{O}_{2})}{{c}^{3}(CO)}$,图表数据分析,随温度升高平衡常数减小,正反应是放热反应,△H<0;
故答案为:$\frac{{c}^{3}(C{O}_{2})}{{c}^{3}(CO)}$,<;
②在一个容积为10L的密闭容器中,1 000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,Q<K=64,反应正向进行,反应经过10min后达到平衡,
令平衡时CO的物质的量变化为nmol,则:
Fe2O3(s)+3CO(g)?Fe(s)+3CO2(g)
开始(mol):1 1
变化(mol):n n
平衡(mol):1-n 1+n
所以$\frac{(1+n)^{3}}{(1-n)^{3}}$=64,解得n=0.6mol,
所以n(CO)=$\frac{\frac{0..6mol}{10L}}{10min}$=0.006mol•L-1•min-1,
CO的平衡转化率为$\frac{0.6mol}{1mol}$×100%=60%,
故答案为:0.006 mol•L-1•min-1;60%;
③A.铁是固体,减少Fe的量,不影响平衡移动,CO的平衡转化率不变,故A错误;
B.氧化铁是固体,增加Fe2O3的量,不影响平衡移动,CO的平衡转化率不变,故B错误;
C.移出部分CO2,平衡向正反应移动,CO的平衡转化率增大,故C正确;
D.该反应正反应是放热反应,提高反应温度,平衡向逆反应移动,CO的平衡转化率降低,故D错误;
E.反应前后气体的物质的量不变,减小容器的容积,增大压强平衡不移动,CO的平衡转化率不变,故E错误;
F.加入合适的催化剂,平衡不移动,故F错误;
故选C;
(4)2.4g碳是0.2mol,燃烧生成0.2molCO2,与0.3molNaOH反应的化学方程式为:2CO2+3NaOH=NaHCO3+Na2CO3+H2O,生成0.1molNa2CO3、0.1molNaHCO3,在含等物质的量的碳酸钠、碳酸氢钠的溶液中,c(Na+)最大,碳酸根离子水解大于碳酸氢根离子的水解,则c(HCO3-)>c(CO32-),水解使溶液显碱性,则c(OH-)>c(H+),显性离子大于隐性离子,所以c(HCO3-)>c(CO32-)>c(OH-)>c(H+),即离子浓度大小为:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),故答案为:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+).
点评 本题考查化学平衡的有关计算、化学反应速率计算、平衡常数等,难度中等,化学平衡移动原理分析判断是关键,题目难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 原子半径:A>B>C>D | B. | 原子序数:b>a>c>d | ||
| C. | 离子半径:D>C>B>A | D. | 金属性:B>A,非金属性:D>C |
| A. | 5种 | B. | 4种 | C. | 3种 | D. | 2种 |
| A. | 该产物的名称是1,1-二甲基丙烷 | |
| B. | 1mol加成产物燃烧消耗6.5mol氧气 | |
| C. | 原单烯烃只可能有3种不同结构 | |
| D. | 原烯烃与分子式是C3H6的烃一定互为同系物 |
| A. | $\frac{4}{5}$v(A)=V(B) | B. | $\frac{5}{6}$v(B)=v(D) | C. | $\frac{2}{3}$v(A)=V(D) | D. | $\frac{4}{5}$v(B)=v(C) |
| A. | 第四周期ⅤB族 | B. | 第四周期ⅡB组 | C. | 第四周期ⅦA族 | D. | 第四周期ⅦB族 |
| 选项 | 实验事实 | 理论解释 |
| A | HCl气体溶于水,能导电 | HCl为离子化合物 |
| B | HBr的酸性强于HCl的酸性 | Br的非金属性比Cl强 |
| C | K3C60在熔融状态下能够导电 | K3C60中含有离子键 |
| D | HF的沸点高于HCl | HF分子间形成有氢键 |
| A. | A | B. | B | C. | C | D. | D |
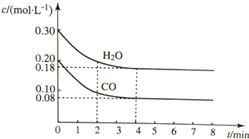 在容积为10L的容器中,通入一定量的CO和H2O(g),在850℃时发生反应CO(g)+H2O?CO2(g)+H2(g)△H<0.CO和H2O浓度变化如图所示.
在容积为10L的容器中,通入一定量的CO和H2O(g),在850℃时发生反应CO(g)+H2O?CO2(g)+H2(g)△H<0.CO和H2O浓度变化如图所示.(1)则0~4min内反应速率v(CO)为0.03mol/(L•min);
(2)1000℃时,在相同容器中发生上述反应,容器内各物质的浓度变化如下表.
1000℃时物质浓度的变化
| t/min | c(CO)/(mol•L-1) | c(H2O)/(mol•L-1) | c(CO2)/(mol•L-1) | c(H2)/(mol•L-1) |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 1 | 0.138 | 0.238 | 0.062 | 0.062 |
| 2 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
| 5 | 0.116 | 0.216 | 0.084 | 0.084 |
| 6 | 0.096 | 0.266 | 0.104 | 0.104 |
②表中5~6min之间数值发生变化,可能的原因是a(填字母).
a.增加水蒸气
b.降低温度
c.使用催化剂
d.增加氢气浓度.