题目内容
17.“优先反应思想”是一条重要的化学学科思想.根据所学知识及题目提供的相关数据,回答下列问题:(1)向FeBr2溶液中滴加少量氯水,溶液变黄.你认为使溶液变黄的微粒其符号是Fe3+,用实验证明你的观点,简述实验操作及现象取适量反应后的溶液滴加KSCN溶液变红.
(2)用惰性电极电解由等物质的量的NaBr、KI、NaCl组成的混合溶液,阳极首先发生的电极反应式是2I--2e-=I2.
(3)已知常温下一些电解质的相关数据如表:
| H2CO3 | Ka1=4.3×10-7 | HClO | Ka=2.95×10-8 |
| Ka2=5.61×10-11 | AgCl | Ksp=1.77×10-10 | |
| CH3COOH | Ka=1.76×10-5 | Ag2CrO4 | Ksp=1.12×10-12 |
②向浓度均为0.010mol•L-1的NaCl、Na2CrO4组成的混合溶液中逐滴加入浓度为0.010mol•L-1AgNO3溶液,首先生成的沉淀其化学式为AgCl.
(4)分别向四份各100mL、浓度均为2mol•L-1的FeCl3溶液中,加入铁、铜组成的均匀粉末状混合物,得到如下数据:
| Ⅰ | Ⅱ | Ⅲ | Ⅳ | |
| FeCl3溶液体积/mL | 100 | 100 | 100 | 100 |
| 加入粉末质量/g | 3 | 6.6 | 9 | 12 |
| 剩余粉末质量/g | 0 | 0.64 | 3.2 | 6.4 |
②根据表中的数据分析Ⅰ反应后的溶液中存在的金属阳离子有(用离子符号表示)Fe3+、Fe2+、Cu2+.
分析 (1)向FeBr2溶液中滴加少量氯水,氯气会将亚铁离子和溴离子氧化;铁离子的检验用硫氰化钾溶液;
(2)根据电解池中阴离子的放电顺序结合电极反应式来书写;
(3)①弱酸的酸性越弱,其酸根越易结合氢离子;
②析出沉淀时,AgCl溶液中c(Ag+)=$\frac{Ksp(AgCl)}{c(C{l}^{-})}$,Ag2CrO4溶液中c(Ag+)=$\sqrt{\frac{Ksp(A{g}_{2}Cr{O}_{4})}{c(Cr{{O}_{4}}^{-})}}$,c(Ag+)越小,则越先生成沉淀;
(4)2mol•L-1的FeCl3溶液中,加入铁、铜组成的均匀粉末状混合物,先是金属铁和氯化铁之间的反应,金属铁消耗完毕后,是金属铜和氯化铁之间的反应,根据提供数据结合金属的反应先后顺序来回答判断.
解答 解:(1)向FeBr2溶液中滴加少量氯水,氯气会将亚铁离子和溴离子氧化,产物分别是铁离子和溴单质,铁离子在溶液中呈现浅黄色,所以使溶液变黄的微粒铁离子的是铁离子,检验铁离子可以用硫氰化钾溶液,溶液会变红色,故答案为:Fe3+;取适量反应后的溶液滴加KSCN溶液变红;
(2)电解池中阴离子的放电顺序:碘离子>溴离子>氯离子,阳极首先发生反应的是碘离子,反应的电极反应式是:2I--2e-=I2;故答案为:2I--2e-=I2;
(3)①弱酸的酸性越弱,其酸根越易结合氢离子,根据表中数据,平衡常数越小,对应弱酸的酸性越弱,越易结合氢离子,所以等物质的量浓度的Na2CO3、CH3COONa、NaClO组成的混合溶液中逐滴加入稀硫酸,首先发生反应的离子方程式是CO32-+H+=HCO3-,故答案为:CO32-+H+=HCO3-;
②析出沉淀时,AgCl溶液中c(Ag+)=$\frac{Ksp(AgCl)}{c(C{l}^{-})}$=$\frac{1.56×1{0}^{-10}}{0.01}$=1.56×10-8,Ag2CrO4溶液中c(Ag+)=$\sqrt{\frac{Ksp(A{g}_{2}Cr{O}_{4})}{c(Cr{{O}_{4}}^{-})}}$=$\sqrt{\frac{9.0×1{0}^{-12}}{0.01}}$=3×10-5,氯离子和铬酸根离子的浓度是相等的,c(Ag+)越小,则越先生成沉淀,所以种阴离子产生沉淀的先后顺序为Cl->CrO42-,故答案为:AgCl;
(4)①根据后三组数据可以看出,多加入金属的质量和多剩余金属的质量之比是一定值,所以最后应该是金属铁完全消耗,金属铜剩余,铁离子完全反应的情况,所以粉末中铁、铜的物质的量相等,物质的量之比为1:1,故答案为:1:1;
②加入金属铁和金属铜,没有金属剩余,金属铁和氯化铁反应一定会产生亚铁离子,铜和铁离子之间反应一定会生成铜离子和亚铁离子,根据第二组数据,加入金属混合物6.6g,剩余金属是0.64g,所以加入3g金属时,铁离子还会剩余,故Ⅰ反应后的溶液中存在的金属阳离子有:Fe3+、Fe2+、Cu2+.
故答案为:Fe3+、Fe2+、Cu2+.
点评 本题综合考查学生混合物组成的计算、电解池的工作原理、沉淀溶解平衡的计算等知识,属于综合知识的考查,难度不大.

 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案
| A. | 图1的目的是检验装置的气密性 | |
| B. | 图2中分液漏斗振荡静置后,上层液体颜色变浅 | |
| C. | 图3中电流计的指针不发生偏转 | |
| D. | 图4液态水分解的热化学方程式为:2H2O(1)═2H2(g)+O2(g)△H=+571.6KJ/mol |
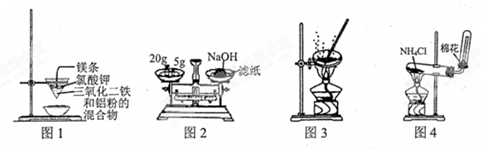
| A. | 用图1装置制取金属铁 | |
| B. | 用图2装置称量NaOH固体 | |
| C. | 用图3装置蒸干CuCl2饱和溶液制备CuCl2晶体 | |
| D. | 用图4装置制取氨气 |
①H2(g)+HCl=HClI(g)+H(g)(慢)
②H(g)+ICl(g)=HCl(g)+I(g)(快)
③HClI(g)=HCl(g)+I(g)(快)
④I(g)+I(g)=I2(g)(快)
下列有关该反应的说法正确的是( )
| A. | 该反应的速率主要①决定 | B. | HClI是该反应的催化剂 | ||
| C. | v(H2)=v(HCl)=v(I2) | D. | a值越小,该反应速率越快 |
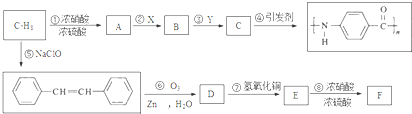
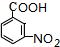 .A~E中互为同分异构体的还有
.A~E中互为同分异构体的还有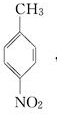 和
和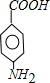 .(填结构简式)
.(填结构简式)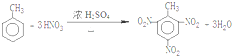 .
.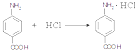 .
.

 (立方烷)
(立方烷) (环辛四烯)
(环辛四烯)