题目内容
9.有一环状化合物C8H8它能使含溴的CCl4溶液褪色.也能使酸性高锰酸钾溶液褪色,并且它的分子中碳上的一个氢原子被氯取代后的衍生物只有一种,这种环状物可能是( )| A. |  | B. | 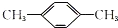 | C. | 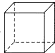 (立方烷) (立方烷) | D. | 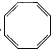 (环辛四烯) (环辛四烯) |
分析 C8H8,它能使溴的CCl4溶液褪色,则含碳碳双键,它的分子中碳环上的1个氢原子被氯取代后的有机物只有1种,则结构中只有一种位置的H,以此来解答.
解答 解:C8H8,它能使溴的CCl4溶液褪色,则含碳碳双键,它的分子中碳环上的1个氢原子被氯取代后的有机物只有1种,则结构中只有一种位置的H,
A.含双键,碳环上有3种H,烃基上有2种H,一氯代物有5种,故A不选;
B.不含双键,分子式为C8H10,故B不选;
C.不含双键,不能使含溴的CCl4溶液褪色,也不能使酸性离锰酸钾溶液褪色,故C不选;
D.含双键,能使含溴的CCl4溶液褪色,也能使酸性离锰酸钾溶液褪色,分子式为C8H0,故D选;
故选D.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团及性质、结构的对称性为解答的关键,注意双键判断及结构中H种类的判断,题目难度不大.

练习册系列答案
 全能测控期末小状元系列答案
全能测控期末小状元系列答案
相关题目
16.某工厂用FeCl3溶液腐蚀镀有铜的绝缘板生产印刷电路(已知发生的反应为:2FeCl3+Cu→2FeCl2+CuCl2).课外活动小组为确认生产后的废液的组成,进行如下实验:(1)取10mL废液加入足量的AgNO3溶液,生成沉淀 8.61g.(2)另取10mL废液放入铜片充分反应,铜片质量减少了0.256g.下列关于原废液及其形成的判断正确的是( )
| A. | c(Fe2+):c(Fe3+)=3:1 | B. | c(Fe3+):c(Cu2+)=4:3 | ||
| C. | c(CI-)=6mol/L,c(Fe2+)=0.6mol/L | D. | 该绝缘板腐蚀后质量减少0.384g |
17.“优先反应思想”是一条重要的化学学科思想.根据所学知识及题目提供的相关数据,回答下列问题:
(1)向FeBr2溶液中滴加少量氯水,溶液变黄.你认为使溶液变黄的微粒其符号是Fe3+,用实验证明你的观点,简述实验操作及现象取适量反应后的溶液滴加KSCN溶液变红.
(2)用惰性电极电解由等物质的量的NaBr、KI、NaCl组成的混合溶液,阳极首先发生的电极反应式是2I--2e-=I2.
(3)已知常温下一些电解质的相关数据如表:
①向等物质的量浓度的Na2CO3、CH3COONa、NaClO组成的混合溶液中逐滴加入稀硫酸,首先发生反应的离子方程式是CO32-+H+=HCO3-.
②向浓度均为0.010mol•L-1的NaCl、Na2CrO4组成的混合溶液中逐滴加入浓度为0.010mol•L-1AgNO3溶液,首先生成的沉淀其化学式为AgCl.
(4)分别向四份各100mL、浓度均为2mol•L-1的FeCl3溶液中,加入铁、铜组成的均匀粉末状混合物,得到如下数据:
①根据表中的数据可求出粉末中铁、铜的物质的量之比为1:1.
②根据表中的数据分析Ⅰ反应后的溶液中存在的金属阳离子有(用离子符号表示)Fe3+、Fe2+、Cu2+.
(1)向FeBr2溶液中滴加少量氯水,溶液变黄.你认为使溶液变黄的微粒其符号是Fe3+,用实验证明你的观点,简述实验操作及现象取适量反应后的溶液滴加KSCN溶液变红.
(2)用惰性电极电解由等物质的量的NaBr、KI、NaCl组成的混合溶液,阳极首先发生的电极反应式是2I--2e-=I2.
(3)已知常温下一些电解质的相关数据如表:
| H2CO3 | Ka1=4.3×10-7 | HClO | Ka=2.95×10-8 |
| Ka2=5.61×10-11 | AgCl | Ksp=1.77×10-10 | |
| CH3COOH | Ka=1.76×10-5 | Ag2CrO4 | Ksp=1.12×10-12 |
②向浓度均为0.010mol•L-1的NaCl、Na2CrO4组成的混合溶液中逐滴加入浓度为0.010mol•L-1AgNO3溶液,首先生成的沉淀其化学式为AgCl.
(4)分别向四份各100mL、浓度均为2mol•L-1的FeCl3溶液中,加入铁、铜组成的均匀粉末状混合物,得到如下数据:
| Ⅰ | Ⅱ | Ⅲ | Ⅳ | |
| FeCl3溶液体积/mL | 100 | 100 | 100 | 100 |
| 加入粉末质量/g | 3 | 6.6 | 9 | 12 |
| 剩余粉末质量/g | 0 | 0.64 | 3.2 | 6.4 |
②根据表中的数据分析Ⅰ反应后的溶液中存在的金属阳离子有(用离子符号表示)Fe3+、Fe2+、Cu2+.
4.利用下列实验器材(规格和数量不限)不能完成相应实验的一项是( )
| 选项 | 实验器材(省略夹持装置) | 相应实验 |
| A | 烧杯、玻璃棒、坩埚、坩埚钳、酒精灯、三脚架 | 灼烧FeCl3固体 |
| B | 烧杯、玻璃棒、胶头滴管、漏斗、滤纸、带铁圈的铁架台 | 用NaOH溶液除去Fe粉中少量Al |
| C | 烧杯、玻璃棒、胶头滴管、容量瓶、量筒 | 用10mol•L-1的硫酸配置0.1mol•L-1的硫酸 |
| D | 烧杯、玻璃棒、胶头滴管、分液漏斗 | 用溴水和CCl4除去NaBr溶液中的少量NaI |
| A. | A | B. | B | C. | C | D. | D |
1.关于常温下0.1mol/L氨水(pH=11)的下列说法正确的是( )
| A. | 根据题中信息,可推断氨水显弱碱性 | |
| B. | 加水稀释过程中,c(H+)/c(OH-) 的值减小 | |
| C. | 与同温下pH=11的NaOH溶液相比,NaOH溶液中c(Na+)大于氨水中c(NH4+) | |
| D. | 加入少量NH4Cl 固体,溶液中水的电离平衡:H2O?H++OH-向右移动 |
18.下列说法正确的是( )
| A. | 青铜、碳素钢和石英都是合金 | |
| B. | 陶瓷、玻璃和水泥都是无机非金属材料 | |
| C. | 乙醇与乙醛互为同分异构体,都能发生银镜反应 | |
| D. | 油脂皂化和蛋白质水解都是由高分子生成小分子的过程 |
19.向等物质的量浓度的NaOH和Ca(OH)2的混合液中通入一定量CO2.下列离子方程式与事实不相符的是( )
| A. | OH-+CO2→HCO3- | |
| B. | 2OH-+CO2→CO32-+H2O | |
| C. | Ca2++2OH-+CO2→CaCO3↓+H2O | |
| D. | Ca2++4OH-+2CO2→CaCO3↓+CO32-+2H2O |