题目内容
【题目】氮族元素及其化合物应用广泛。如合成氨、磷肥等化学肥料促进了粮食产量的极大提高。
(1)在基态31P原子中,核外存在_____对自旋相反的电子,核外电子占据的最高能级的电子云轮廓图为_____形。与31P同周期且相邻的元素的第一电离能由大到小的顺序为_____。
(2)液氨中存在电离平衡2NH3![]() NH4++NH2﹣,体系中三种微粒中N原子的杂化方式为_____,NH2﹣的立体构型为_____,与NH4+互为等电子体的分子为_____。
NH4++NH2﹣,体系中三种微粒中N原子的杂化方式为_____,NH2﹣的立体构型为_____,与NH4+互为等电子体的分子为_____。
(3)苯胺 ![]() 与甲苯
与甲苯 ![]() 的相对分子质量相近,但苯胺的熔点(﹣5.9℃)、沸点(184.4℃)分别高于甲苯的熔点(﹣95℃)、沸点(110.6℃),原因是_____。
的相对分子质量相近,但苯胺的熔点(﹣5.9℃)、沸点(184.4℃)分别高于甲苯的熔点(﹣95℃)、沸点(110.6℃),原因是_____。
(4)我国科学工作者实现世界首次全氮阴离子(N5﹣)金属盐Co(N5)2(H2O)44H2O的合成,其结构如图所示,Co2+的配位数为_____;N5﹣的化学键类型为_____。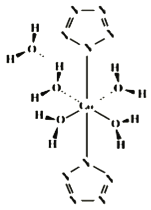
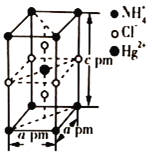
(5)把特定物质的量之比的NH4Cl和HgCl2在密封管中一起加热时,生成晶体X,其晶胞的结构图及晶胞参数如图所示。则晶体X的密度为_____ g/cm3(设阿伏加德罗常数的值为NA,列出计算式)。
【答案】6 哑铃(纺锤) P>S>Si sp 3 杂化 V 形 CH4、SiH4 苯胺分子间存在氢键 6 σ键、π键 ![]()
【解析】
(1)、根据31P原子的电子排布1s22s22p63s23p2解答;
(2)、根据价层电子对互斥理论解答;
(3)、同为分子晶体,且相对分子质量差较小,而熔沸点相差较大,则可能是存在分子间氢键;
(4)、根据图示可以确定物质中存在的化学键;
(5)、由均摊法可知,1个晶胞中Hg2+数目为1,NH4+数目为1,Cl﹣数目为3,晶体密度ρ=![]() ,据此计算。
,据此计算。
(1)31P原子的电子排布是1s22s22p63s23p2,可知核外存在6对自旋相反的电子,最外层为p轨道,电子云轮廓图为哑铃(纺锤)形。与P同周期相邻的元素为Si、S,同周期随原子序数增大,元素第一电离能呈增大趋势,P元素原子3p能级为半满稳定状态,能量较低,第一电离能高于同周期相邻元素的,故第一电离能:P>S>Si。
故答案为:6;哑铃(纺锤); P>S>Si;
(2)NH3中心原子N电子对数=![]() (5﹣1×3)+3=4,杂化方式为sp 3;NH4+中心原子N电子对数=
(5﹣1×3)+3=4,杂化方式为sp 3;NH4+中心原子N电子对数=![]() (5﹣1﹣1×4)+4=4,杂化方式为sp 3;NH2﹣中心原子N电子对数=
(5﹣1﹣1×4)+4=4,杂化方式为sp 3;NH2﹣中心原子N电子对数=![]() (5+1﹣1×2)+2=4,杂化方式为sp 3,孤电子对数为2,空间构型为V形。等电子体为原子数相等和电子数相等的原子团,NH4+含有5个原子,电子数为10,与NH4+互为等电子体的分子为CH4、SiH4等
(5+1﹣1×2)+2=4,杂化方式为sp 3,孤电子对数为2,空间构型为V形。等电子体为原子数相等和电子数相等的原子团,NH4+含有5个原子,电子数为10,与NH4+互为等电子体的分子为CH4、SiH4等
故答案为:sp 3 杂化; V 形;CH4、SiH4;
(3)苯胺![]() )的晶体类型是分子晶体,构成微粒为分子,苯胺与甲苯(
)的晶体类型是分子晶体,构成微粒为分子,苯胺与甲苯(![]() )的相对分子质量相近,但苯胺的熔点(﹣5.9℃)、沸点(184.4℃)分别高于甲苯的熔点(﹣95.0℃)、沸点(110.6℃),原因是苯胺分子之间存在氢键,
)的相对分子质量相近,但苯胺的熔点(﹣5.9℃)、沸点(184.4℃)分别高于甲苯的熔点(﹣95.0℃)、沸点(110.6℃),原因是苯胺分子之间存在氢键,
故答案为:苯胺分子间存在氢键;
(4)由图知,Co(N5)2(H2O)44H2O中Co2+连接2个(N5﹣)和4个H2O,其配位数为6,N5﹣存在的化学键为σ键、π键。
故答案为:6; σ键、π键;
(5)由均摊法可知,1个晶胞中Hg2+数目为1,NH4+数目为8×![]() =1,Cl﹣数目为4×
=1,Cl﹣数目为4×![]() +2=3,晶胞质量m=
+2=3,晶胞质量m=![]() =
=![]() ,晶胞体积V=a×10﹣10×a×10﹣10×c×10﹣10=a2c×10﹣30,晶体X的密度ρ=
,晶胞体积V=a×10﹣10×a×10﹣10×c×10﹣10=a2c×10﹣30,晶体X的密度ρ=![]() =
=![]() g/cm3,
g/cm3,
故答案为:![]() 。
。