题目内容
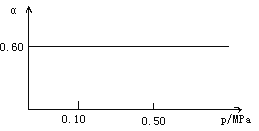
【题目】一定条件下,在容积为1 L的密闭容器中发生可逆反应:Fe(s)+H2O(g) ![]() FeO(s)+H2(g) ΔH>0。在1 000℃时,H2O(g)的平衡转化率(α)与体系总压强(p)关系如图所示。
FeO(s)+H2(g) ΔH>0。在1 000℃时,H2O(g)的平衡转化率(α)与体系总压强(p)关系如图所示。
(1)写出该反应的平衡常数表达式K=__________。当反应达到平衡后,再向容器中加入铁粉和水蒸气,则K__________,(填“增大”、“减小”或“不变”,下同);升高温度,则K__________。
(2)在1 000℃时,若向上述容器中加入0.80 mol铁粉和1.00 mol水蒸气,达到平衡时,容器中c(H2)=______。
【答案】 c(H2)/c(H2O) 不变 增大 0.6 mol/L
【解析】(1)平衡常数为生成物浓度系数次幂的乘积与反应物浓度系数次幂的乘积的比值,由于Fe和FeO属于固体,则K=![]() ;化学平衡常数只与温度有关,温度不变,K不变;△H>0,反应吸热,升高温度,化学平衡向正反应方向移动,生成物浓度增大,反应物浓度减小,化学平衡常数增大,故答案为:
;化学平衡常数只与温度有关,温度不变,K不变;△H>0,反应吸热,升高温度,化学平衡向正反应方向移动,生成物浓度增大,反应物浓度减小,化学平衡常数增大,故答案为: ![]() 、不变、增大;
、不变、增大;
(2)1.00mol水蒸气在容器中浓度为![]() =
=![]() =1mol/L,根据图像,水的转化率为0.6,因此c(H2)=△c(H2O)=1mol/L×0.6=0.6mol/L,故答案为:0.6mol/L。
=1mol/L,根据图像,水的转化率为0.6,因此c(H2)=△c(H2O)=1mol/L×0.6=0.6mol/L,故答案为:0.6mol/L。

练习册系列答案
 新思维寒假作业系列答案
新思维寒假作业系列答案
相关题目

