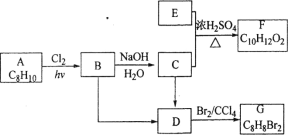
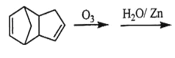
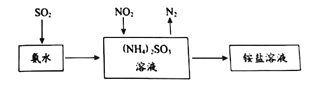
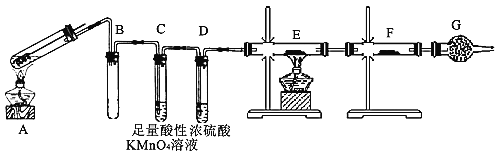
��Ŀ����
����Ŀ��ij�㶨�¶��£���һ��2L���ܱ������У�����4 mol A��2 mol B�������·�Ӧ:3A (g)+2B (g)4C (?)+2D (?),��?������״̬��ȷ������Ӧһ��ʱ���ﵽƽ�⣬������� 1.6 mol C,�ҷ�Ӧǰ��ѹǿ֮��Ϊ5:4,������˵����ȷ����
A.����C,B��ƽ��ת���ʲ���
B.��ʱB��ƽ��ת������35%
C.�������ϵ��ѹǿ��ƽ�������ƶ�����ѧƽ�ⳣ������
D.�÷�Ӧ�Ļ�ѧƽ�ⳣ������ʽ��K=![]()
���𰸡�A
��������
�������֪��Ӧ��ǰ��ѹǿ֮��Ϊ 5��4��˵����Ӧ�����������С�ķ�Ӧ����C��D ������ֻ��һ�������壬������ʽ��

���ڣ�4+2������2.8+1.2+1.6��=15��14��5��4����4+2������2.8+1.2+0.8��=5��4������C�ﲻ�����壬D��Ϊ���塣
A.����Ӧ��ϵ�����ʵ�Ũ�ȣ�ƽ����Ũ�ȼ�С�ķ����ƶ�����C�������壬����C����ʹƽ�������ƶ�������B ��ƽ��ת���ʲ��䣬��A��ȷ��
B.B��ƽ��ת����=0.8mol��2mol��100%=40%����B����
C.��ѧƽ�ⳣ��ֻ���¶��йأ��¶Ȳ�����ƽ�ⳣ�����䣬��C����
D.����������CΪ�����壬��Ũ��Ϊ1�����Ը÷�Ӧ�Ļ�ѧƽ�ⳣ������ʽK=![]() ����D����
����D����
�ʴ�ΪA��