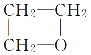ΧβΡΩΡΎ»ί
ΓΨΧβΡΩΓΩ2019Ρξ «ΓΑΙζΦ Μ·―ß‘ΣΥΊ÷ήΤΎ±μΡξΓ±ΓΘ1869ΡξΟ≈ΫίΝ–ΖρΑ―Β± ±“―÷ΣΒΡ‘ΣΥΊΗυΨί‘ΣΥΊ–‘÷ ΓΔœύΕ‘‘≠Ή”÷ ΝΩΒ»Ϋχ––≈≈Ν–Θ§‘ΛΝτΝΥΦΉΓΔ““ΝΫ÷÷Έ¥÷Σ‘ΣΥΊΒΡΈΜ÷ΟΘ§≤Δ‘Λ≤βΝΥΕΰ’ΏΒΡœύΕ‘‘≠Ή”÷ ΝΩΘ§≤ΩΖ÷‘≠ ΦΦ«¬Φ»γœ¬ΓΘœ¬Ν–ΥΒΖ®¥μΈσΒΡ «

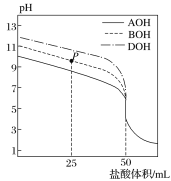
A.““‘ΣΥΊΈΜ”Ύœ÷––‘ΣΥΊ÷ήΤΎ±μΒΎΥΡ÷ήΤΎΒΎΔωAΉεB.‘≠Ή”ΑκΨΕΘΚΦΉ>““> Si
C.““ΒΡΦρΒΞΤχΧ§«βΜ·ΈοΒΡΈ»Ε®–‘»θ”ΎCH4D.ΆΤ≤β““ΒΡΒΞ÷ Ω…“‘”ΟΉςΑκΒΦΧε≤ΡΝœ
ΓΨ¥πΑΗΓΩA
ΓΨΫβΈωΓΩ
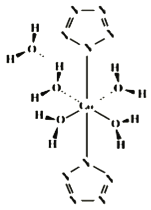
”…ΆΦΩ…÷ΣΘ§Ά§“ΜΝ–ΈΣΆ§“Μ÷ήΤΎ‘ΣΥΊΘ§ΕχΆ§“ΜΚα––ΈΣΆ§÷ςΉε‘ΣΥΊΘ§”…‘ΣΥΊΒΡœύΕ‘‘≠Ή”÷ ΝΩΩ…÷ΣΘ§ΦΉΓΔ““ΒΡœύΕ‘‘≠Ή”÷ ΝΩΨυ±»As–ΓΘ§AsΈΜ”ΎΒΎΥΡ÷ήΤΎVAΉεΘ§‘ρCΓΔSiΓΔ““ΈΜ”ΎΒΎIVAΉεΘ§““ΈΣGeΘ§BΓΔAlΓΔΦΉΈΜ”ΎΔσAΉεΘ§ΦΉΈΣGaΘ§“‘¥Υά¥Ϋβ¥πΓΘ
”…ΆΦΩ…÷ΣΘ§Ά§“ΜΝ–ΈΣΆ§“Μ÷ήΤΎ‘ΣΥΊΘ§ΕχΆ§“ΜΚα––ΈΣΆ§÷ςΉε‘ΣΥΊΘ§”…‘ΣΥΊΒΡœύΕ‘‘≠Ή”÷ ΝΩΩ…÷ΣΘ§ΦΉΓΔ““ΒΡœύΕ‘‘≠Ή”÷ ΝΩΨυ±»As–ΓΘ§AsΈΜ”ΎΒΎΥΡ÷ήΤΎVAΉεΘ§‘ρCΓΔSiΓΔ““ΈΜ”ΎΒΎIVAΉεΘ§““ΈΣGeΘ§BΓΔAlΓΔΦΉΈΜ”ΎΔσAΉεΘ§ΦΉΈΣGaΘ§
A. ““ΈΣGeΘ§ΈΜ”Ύœ÷––‘ΣΥΊ÷ήΤΎ±μΒΎΥΡ÷ήΤΎΒΎIVAΉεΘ§Aœν¥μΈσΘΜ
B. Ά§÷ήΤΎΉ‘ΉσΕχ”“‘≠Ή”ΑκΨΕΦθ–ΓΘ§Ά§÷ςΉεΉ‘…œΕχœ¬‘≠Ή”ΑκΨΕ‘ω¥σΘ§Ι ‘≠Ή”ΑκΨΕΘΚΦΉ(Ga)>““(Ge)>SiΘ§Bœν’ΐ»ΖΘΜ
C. ΧΦ”κGeΆ§÷ςΉε«“ΒγΉ”≤ψ‘ωΕύΘ§Ζ«Ϋπ τ–‘C>GeΘ§‘ρGeΒΡΦρΒΞΤχΧ§«βΜ·ΈοΒΡΈ»Ε®–‘»θ”ΎCH4Θ§Cœν’ΐ»ΖΘΜ
D. ““ΈΣGeΘ§ΈΜ”ΎΫπ τ”κΖ«Ϋπ τΒΡΫΜΫγ¥ΠΘ§Ω…”ΟΉςΑκΒΦΧε≤ΡΝœΘ§Dœν’ΐ»ΖΘΜ
¥πΑΗ―ΓAΓΘ

 ‘ΡΕΝΩλ≥ΒœΒΝ–¥πΑΗ
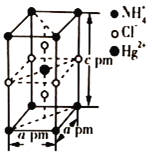
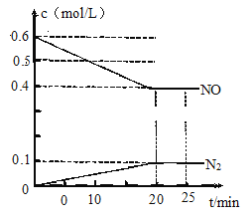
‘ΡΕΝΩλ≥ΒœΒΝ–¥πΑΗΓΨΧβΡΩΓΩ Β―ι “άο”ΟΦ”»»’ΐΕΓ¥ΦΓΔδεΜ·ΡΤΚΆ≈®ΝρΥαΒΡΜλΚœΈοΒΡΖΫΖ®ά¥÷Τ±Η1ΓΣδεΕΓΆι ±Θ§ΜΙΜα”–œ©ΓΔΟ―ΚΆδεΒ»≤ζΈο…ζ≥…ΓΘΖ¥”ΠΫα χΚσΫΪΖ¥”ΠΜλΚœΈο’τΝσΘ§Ζ÷άκΒΟΒΫ1ΓΣδεΕΓΆιΓΘ“―÷Σ”–ΙΊΈο÷ ΒΡ–‘÷ »γœ¬ΘΚ
ΓΓ | »έΒψ/Γφ | Ζ–Βψ/Γφ | ΟήΕ»/gΓΛcmΘ≠3 |
’ΐΕΓ¥Φ | ΓΣ89.53 | 117.25 | 0.81 |
1ΓΣδεΕΓΆι | ΓΣ112.4 | 101.6 | 1.28 |
ΕΓΟ― | 95.3 | 142 | 0.76 |
1ΓΣΕΓœ© | ΓΣ185.3 | ΓΣ6.5 | 0.59 |
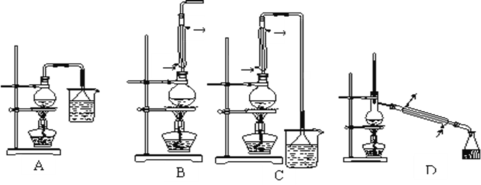
(1) …ζ≥…1ΓΣδεΕΓΆιΒΡΖ¥”ΠΉΑ÷ϔЯÔυœΆΦ÷–ΒΡΉΑ÷Ο_____Θ®Χν–ρΚ≈Θ©Θ§
(2)”…”ΎΖΔ…ζΗ±Ζ¥”ΠΕχ…ζ≥…ΕΓΟ―ΒΡΖ¥”Πάύ–ΆΈΣ_____
(3)”…”ΎΖΔ…ζΗ±Ζ¥”ΠΕχ…ζ≥…1ΓΣΕΓœ©ΒΡΜ·―ßΖΫ≥Χ Ϋ_____
(4)Ζ¥”ΠΫα χΚσΘ§ΫΪΖ¥”ΠΜλΚœΈο÷–1ΓΣδεΕΓΆιΖ÷άκ≥ωά¥”ЯÔυœΆΦ÷–ΒΡΉΑ÷Ο__Θ®Χν–ρΚ≈Θ©Θ§ΗΟ≤ΌΉς”ΠΩΊ÷ΤΒΡΈ¬Ε»t2ΖΕΈß «___ΓφΓΘ