题目内容
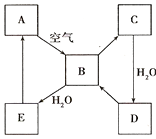
【题目】某化学兴趣小组用下图装置制取并探究氯气的性质。[A装置中发生反应的化学方程式:2KMnO4+16HCl(浓) == 2KCl+2MnCl2 + 5Cl2↑+ 8H2O ]

【实验探究】
(1)A装置中a仪器的名称是_____________。
(2)制取氯气反应中KMnO4所起的作用是_____(填“氧化剂”或“还原剂”)。
(3)实验进行一段时间后,可观察到______(填“B”或“C”)装置中有色布条褪色,其褪色原因是______________________________________。
(4)当氯气进入D装置后,可观察到溶液颜色变为_______(填“红色”或“蓝色”),写出相关反应的化学方程式___________________________________。
(5)E装置中NaOH溶液的作用是_____________________________________。
(6)用31.6 g KMnO4固体与足量的浓盐酸反应,最多可生成标准状况下_____L氯气。(KMnO4的摩尔质量为158 g·mol—1)
【知识拓展】
(7)近年来,某些含氯的化合物(如ClO2、NaClO等)在生产、生活中应用广泛。
①高效净水剂ClO2中氯元素的化合价为_____________。
②NaClO是一种强氧化剂。某种家用洗涤剂含有NaClO,请写出NaClO在洗涤过程中的一种作用___________________________________________。
【答案】 圆底烧瓶 氧化剂 C 氯气与水反应生成漂白性物质(HClO) 蓝色 Cl2 + 2KI == I2 + 2KCl 除去(或吸收)多余氯气,防止污染空气 11.2 +4 杀菌
【解析】(1)根据仪器构造可知A装置中a仪器的名称是圆底烧瓶。(2)制取氯气反应中Mn元素化合价降低,得到电子,所以KMnO4所起的作用是氧化剂。(3)氯气没有漂白性,与水反应生成的次氯酸具有漂白性,所以实验进行一段时间后,可观察到C装置中有色布条褪色。(4)当氯气进入D装置后,由于氯气具有强氧化性,能把碘化钾氧化为单质碘,碘遇淀粉显蓝色,所以可观察到溶液颜色变为蓝色,反应的化学方程式为Cl2+2KI==I2+2KCl。(5)氯气有毒,需要尾气处理,所以E装置中NaOH溶液的作用是除去(或吸收)多余氯气,防止污染空气。(6)31.6gKMnO4固体的物质的量是31.6g÷158g/mol=0.2mol,根据方程式可知与足量的浓盐酸反应,最多可生成0.5mol氯气,在标准状况下的体积为0.5mol×22.4L/mol=11.2L。(7)①高效净水剂ClO2中氧元素化合价是-2价,根据正负价代数和为0可知氯元素的化合价为+4价。②NaClO具有强氧化性,在洗涤过程中的一种作用是杀菌消毒。

 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案【题目】已知下表数据:
物质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
Ksp(25℃) | 8.0×10-16 | 2.2×10-20 | 4.0×10-33 |
完全沉淀时的pH范围 | ≥9.6 | ≥6.4 | ≥3.4 |
对含等物质的量的CuSO4、FeSO4、Fe2(SO4)3的混合溶液的说法,不正确的是
A. 向该混合溶液中逐滴加入NaOH溶液: 最先看到红褐色沉淀
B. 该溶液中c(SO42-): [c(Cu2+)+c(Fe2+)+c(Fe3+)]>5:4
C. 向该溶液中加入适量氯水,并调节pH到4后过滤,可获得纯净的CuSO4溶液
D. 在:pH=5的溶液中Fe3+不能大量存在