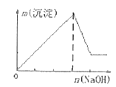
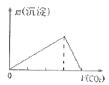
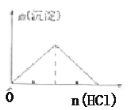
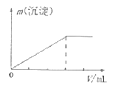
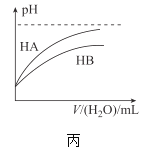
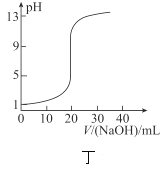
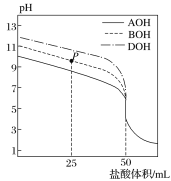
��Ŀ����
����Ŀ�����������Ȼ�ѧ����ʽ��
2H2(g)��O2(g)=2H2O(l) ��H��-571.6 kJ��mol-1
C3H8(g)��5O2(g)=3CO2(g)��4H2O(l) ��H��-2220 kJ��mol-1
�Իش��������⣺
(1)H2��ȼ����Ϊ______��C3H8��ȼ����Ϊ________��
(2)1 mol H2��2 mol C3H8��ɵĻ��������ȫȼ�����ͷŵ�����Ϊ________��
(3)����H2��C3H8�Ļ�����干1 mol����ȫȼ��ʱ�ų�������Ϊ769.4 kJ�����ڻ��������H2��C3H8�������Ϊ________��
���𰸡�285.8 kJ��mol-1 2220 kJ��mol-1 4725.8 kJ 3:1
��������
����ȼ���ȵĶ�����㡣
(1)ȼ������ָ1mol��ȼ����ȫȼ�������ȶ�������ʱ���ų�����������H2��C3H8��ȼ���ȷֱ�Ϊ285.8kJ��mol-1��2220kJ��mol-1��
(2)�ͷ��������ļ���ʽΪQ��=1mol��285.8 kJ��mol-1+2 mol��2220kJ��mol-1=4725.8kJ��
(3)��H2��C3H8�����ʵ����ֱ�Ϊx mol��y mol������
![]()
��ã�![]() ������ͬP��Tʱ��V(H2):V(C3H8)��n(H2):n(C3H8)��3:1��
������ͬP��Tʱ��V(H2):V(C3H8)��n(H2):n(C3H8)��3:1��

��ϰ��ϵ�д�
 Сѧ�̲�ȫ��ϵ�д�
Сѧ�̲�ȫ��ϵ�д� Сѧ��ѧ������ѿڶ���ϵ�д�
Сѧ��ѧ������ѿڶ���ϵ�д� ������Ӧ�������������ϵ�д�
������Ӧ�������������ϵ�д�
�����Ŀ