题目内容
11. 如图所示一套实验装置来制取乙酸乙酯,A中盛有乙醇、浓硫酸和醋酸的混合液,C中盛有饱和碳酸钠溶液.
如图所示一套实验装置来制取乙酸乙酯,A中盛有乙醇、浓硫酸和醋酸的混合液,C中盛有饱和碳酸钠溶液.已知:①氯化钙可与乙醇形成难溶于水的CaCl2•6C2H5OH
②有关有机物的沸点:
| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点(℃) | 34.7 | 78.5 | 117.9 | 77.1 |
(2)反应中所用的乙醇是过量的,其目的是有利于酯化反应向正方向进行(增大醋酸的利用率);
(3)浓硫酸的作用是催化剂、吸收剂;
(4)从C中分离出乙酸乙酯必须使用的一种仪器是分液漏斗;分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入饱和氯化钙溶液分离出乙醇,再加入无水硫酸钠,然后进行蒸馏,收集77℃的馏分,以得到较纯净的乙酸乙酯.
(5)若实验中用含18O的乙醇与乙酸作用,则表示该反应原理的化学方程式是CH3COOH+CH3CH${\;}_{2}^{18}$OH$\stackrel{浓硫酸}{→}$CH3CO18OCH2CH3+H2O.
分析 (1)有缓冲作用的装置能防止倒吸;
(2)增大一种反应物的物质的量,有利于增大另一种反应物的转化率;
(3)浓硫酸具有吸水性和脱水性,在有机反应中常常做催化剂;
(4)分离互不相溶的液体采用分液方法,分液时用分液漏斗分离;氯化钙可与乙醇形成难溶于水的CaCl2•6C2H5OH,所以可以用氯化钙除去乙醇;
(5)在乙醇、乙酸的酯化反应中,乙醇失去-OH上的H原子、乙酸失去羧基上的-OH,二者反应生成乙酸乙酯和水.
解答 解:(1)乙醇和乙酸具有挥发性,所以生成的乙酸乙酯中含有乙醇、乙酸,乙醇、乙酸极易溶于碳酸钠水溶液,倒置干燥管有缓冲作用,能防止倒吸,故答案为:防止倒吸;
(2)制取乙酸乙酯的反应是可逆反应,增大乙醇的物质的量有利于平衡正向移动,从而增大乙酸的转化率,所以乙醇过量的目的是促进平衡正向进行,增大乙酸利用率,
故答案为:有利于酯化反应向正方向进行(增大醋酸的利用率);
(3)浓硫酸具有吸水性和脱水性,能将反应中生成的水吸收而促进平衡正向移动,所以在有机反应中常常做催化剂,故答案为:催化剂、吸水剂;
(4)分离互不相溶的液体采用分液方法,分液时用分液漏斗分离,分液时下层液体从下口倒出,上层液体从上口倒出;氯化钙可与乙醇形成难溶于水的CaCl2•6C2H5OH,从而除去乙醇,所以可以用氯化钙除去乙醇,
故答案为:分液漏斗;乙醇;
(5)在乙醇、乙酸的酯化反应中,乙醇失去-OH上的H原子、乙酸失去羧基上的-OH,二者反应生成乙酸乙酯和水,所以乙醇中的18O在生成物乙酸乙酯中出现,反应方程式为CH3COOH+CH3CH${\;}_{2}^{18}$OH$\stackrel{浓硫酸}{→}$CH3CO18OCH2CH3+H2O,
故答案为:CH3COOH+CH3CH${\;}_{2}^{18}$OH$\stackrel{浓硫酸}{→}$CH3CO18OCH2CH3+H2O.
点评 本题以乙酸乙酯为载体考查制备实验方案设计,明确实验原理及实验基本操作是解本题关键,侧重考查学生获取信息、利用信息解答问题能力,注意乙酸乙酯反应中断键和成键方式,题目难度不大.

| A. | H3PO4?3H++PO43- | B. | BaSO4?Ba2++SO42- | ||
| C. | Al(OH)3?H2O+AlO2-+H+ | D. | NaHS?Na++H++S2- |
| A. | 平衡向右移动 | B. | x+y>z | C. | B的转化率提高 | D. | C的体积分数增加 |
| A. | 3n-12 | B. | 5n-12 | C. | 3n-6 | D. | n-10 |
| A. | H2SO3的酸性比H2CO3的酸性强,说明S的非金属性比C强 | |
| B. | 根据非金属性强弱F>Cl,可以推测沸点HF>HCl | |
| C. | 进行H2O和H2S气体的热分解实验,可确定S、O两种元素的非金属性强弱 | |
| D. | 已知2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,说明C的非金属性比Si强 |
| A. | 氢氧化铝可以用做耐火材料 | |
| B. | 铝热反应能放出大量的热,常用于焊接钢轨等 | |
| C. | 铝合金具有密度大、强度高且有一定的抗腐蚀能力,可用于制造能承受强磨损的构件 | |
| D. | 铜被誉为“21世纪的金属”,其应用前景更为广阔 |
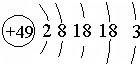 张青莲是我国著名的化学家.1991年,他准确测得In的相对原子质量为114.818,被国际原子量委员会采用为新的标准值.这是原子量表中首次采用我国测定的相对原子质量值.已知In的原子结构如图所示,则下列关于In的说法不正确的是( )
张青莲是我国著名的化学家.1991年,他准确测得In的相对原子质量为114.818,被国际原子量委员会采用为新的标准值.这是原子量表中首次采用我国测定的相对原子质量值.已知In的原子结构如图所示,则下列关于In的说法不正确的是( )| A. | In为长周期元素 | B. | In的最高正化合价为+3 | ||
| C. | In容易导电导热 | D. | In和铝同主族,金属性比铝弱 |
| A. | 金属钠 | B. | 过氧化钠 | C. | 金属镁 | D. | 金属铝 |
| A. | 氢氧化钠溶液盛装在用橡胶塞的试剂瓶中 | |
| B. | 氢氟酸盛装在细口玻璃瓶中 | |
| C. | 硫酸亚铁溶液存放在加有少量铁粉的试剂瓶中 | |
| D. | 金属钠保存在石蜡油或煤油中 |