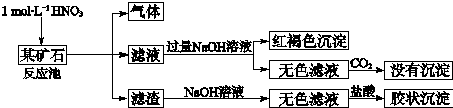
题目内容
6.下列叙述中正确的是( )| A. | H2SO3的酸性比H2CO3的酸性强,说明S的非金属性比C强 | |
| B. | 根据非金属性强弱F>Cl,可以推测沸点HF>HCl | |
| C. | 进行H2O和H2S气体的热分解实验,可确定S、O两种元素的非金属性强弱 | |
| D. | 已知2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,说明C的非金属性比Si强 |
分析 A、是最高价氧化对应的水化物,而不是低价态;
B.非金属性强弱与其氢化物的沸点无关;
C.氢化物越稳定,对应元素的非金属性越强;
D.非金属性越强,对应的单质的氧化性越强,还原性越弱;
解答 解:A.利用最高价氧化物的水化物的酸性比较非金属性,而H2SO3不是最高价氧化物的水化物,则不能比较S、C的非金属性,故A错误;
B.非金属性强弱与其氢化物的沸点无关,不能根据非金属性强弱F>Cl,来确定二者氢化物的沸点高低,故B错误;
C.非金属性越强,气态氢化物越稳定,则进行H2O和H2S的热分解实验,水难分解,则确定S、O两种元素的非金属性为O>S,故C正确;
D.非金属性越强,对应的单质的氧化性越强,还原性越弱,反应2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑是在高温下进行的,C作还原剂,不能说明非金属性C>Si,故D错误;
故选C.
点评 本题考查化学实验方案的评价,侧重非金属性比较的考查,注重规律性知识的总结和应用,明确得电子能力的强的非金属性强,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
16.下列关于苯酚的叙述中,错误的是( )
| A. | 其水溶液显强酸性,俗称石炭酸 | |
| B. | 其浓溶液对皮肤有强烈的腐蚀性,如果不慎沾在皮肤上,应立即用酒精擦洗 | |
| C. | 其在水中的溶解度随温度的升高而增大,超过65℃可以与水以任意比互溶 | |
| D. | 氯化铁溶液中滴入苯酚的水溶液后,溶液呈紫色 |
17.下列反应的离子方程式书写正确的是( )
| A. | 氯化铝溶液中加入过量的氨水:Al3++4NH3•H2O=AlO2-+4NH4++2H2O | |
| B. | 澄清石灰水与苏打溶液混合:Ca2++OH-+HCO3-=CaCO3↓+H2O | |
| C. | 氯化亚铁溶液中通入氯气:2Fe2++Cl2=2Fe3++2Cl- | |
| D. | 碳酸钙溶于醋酸:CaCO3+2H+=Ca2++CO2↑+H2O |
1.已知几种短周期元素的原子半径、常见的最高价和最低价如下表:
请回答下列问题:
(1)B元素在周期表中的位置第二周期第VA族
(2)B的氢化物的沸点比D的氢化物的沸点高;(填:高、低或相等),其理由是氨气中含有氢键、膦不含氢键
(3)写出G的单质与F的最高价氧化物的水化物反应的化学方程式2Al+2H2O+2NaOH=2NaAlO2+3H2↑,
化合物甲由G、E两种元素组成,该化合物甲熔化时破坏了共价键,它的水溶液显酸性(填:酸性、碱性或中性),其原因是Al3++3H2O?Al(OH)3+3H+(用离子方程式表示).
(4)化合物甲由A、F两种元素组成的淡黄色物质中含有的化学键:离子键和共价键
(5)A、B的气态氢化物的稳定性强的是H2O(用化学式表示)
(6)由B、C两种元素组成的离子化合物 (用电子式表示)
(用电子式表示)
(7)B与E两种元素形成的一种化合物乙,该化合物中各原子均满足8电子的稳定结构,则乙的结构式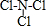 .
.
| 元素性质 | 元素编号 | ||||||
| 原子半径(nm) | A | B | C | D | E | F | G |
| 0.073 | 0.075 | 0.037 | 0.110 | 0.099 | 0.186 | 0.143 | |
| 最高正化合价 | 无 | +5 | +1 | +5 | +7 | +1 | +3 |
| 最低负化合价 | -2 | -3 | -1 | -3 | -1 | 无 | 无 |
(1)B元素在周期表中的位置第二周期第VA族
(2)B的氢化物的沸点比D的氢化物的沸点高;(填:高、低或相等),其理由是氨气中含有氢键、膦不含氢键
(3)写出G的单质与F的最高价氧化物的水化物反应的化学方程式2Al+2H2O+2NaOH=2NaAlO2+3H2↑,
化合物甲由G、E两种元素组成,该化合物甲熔化时破坏了共价键,它的水溶液显酸性(填:酸性、碱性或中性),其原因是Al3++3H2O?Al(OH)3+3H+(用离子方程式表示).
(4)化合物甲由A、F两种元素组成的淡黄色物质中含有的化学键:离子键和共价键
(5)A、B的气态氢化物的稳定性强的是H2O(用化学式表示)
(6)由B、C两种元素组成的离子化合物
 (用电子式表示)
(用电子式表示)(7)B与E两种元素形成的一种化合物乙,该化合物中各原子均满足8电子的稳定结构,则乙的结构式
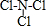 .
.
11. 如图所示一套实验装置来制取乙酸乙酯,A中盛有乙醇、浓硫酸和醋酸的混合液,C中盛有饱和碳酸钠溶液.
如图所示一套实验装置来制取乙酸乙酯,A中盛有乙醇、浓硫酸和醋酸的混合液,C中盛有饱和碳酸钠溶液.
已知:①氯化钙可与乙醇形成难溶于水的CaCl2•6C2H5OH
②有关有机物的沸点:
(1)球形管B除起冷凝作用外,另一重要作用是防止倒吸;
(2)反应中所用的乙醇是过量的,其目的是有利于酯化反应向正方向进行(增大醋酸的利用率);
(3)浓硫酸的作用是催化剂、吸收剂;
(4)从C中分离出乙酸乙酯必须使用的一种仪器是分液漏斗;分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入饱和氯化钙溶液分离出乙醇,再加入无水硫酸钠,然后进行蒸馏,收集77℃的馏分,以得到较纯净的乙酸乙酯.
(5)若实验中用含18O的乙醇与乙酸作用,则表示该反应原理的化学方程式是CH3COOH+CH3CH${\;}_{2}^{18}$OH$\stackrel{浓硫酸}{→}$CH3CO18OCH2CH3+H2O.
 如图所示一套实验装置来制取乙酸乙酯,A中盛有乙醇、浓硫酸和醋酸的混合液,C中盛有饱和碳酸钠溶液.
如图所示一套实验装置来制取乙酸乙酯,A中盛有乙醇、浓硫酸和醋酸的混合液,C中盛有饱和碳酸钠溶液.已知:①氯化钙可与乙醇形成难溶于水的CaCl2•6C2H5OH
②有关有机物的沸点:
| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点(℃) | 34.7 | 78.5 | 117.9 | 77.1 |
(2)反应中所用的乙醇是过量的,其目的是有利于酯化反应向正方向进行(增大醋酸的利用率);
(3)浓硫酸的作用是催化剂、吸收剂;
(4)从C中分离出乙酸乙酯必须使用的一种仪器是分液漏斗;分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入饱和氯化钙溶液分离出乙醇,再加入无水硫酸钠,然后进行蒸馏,收集77℃的馏分,以得到较纯净的乙酸乙酯.
(5)若实验中用含18O的乙醇与乙酸作用,则表示该反应原理的化学方程式是CH3COOH+CH3CH${\;}_{2}^{18}$OH$\stackrel{浓硫酸}{→}$CH3CO18OCH2CH3+H2O.
18.有机物的种类繁多,但其命名是有规则的.下列有机物命名正确的是( )
| A. | CH2=CH-CH=CH2 1,3二丁烯 | B. | 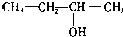 3-丁醇 | ||
| C. | 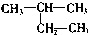 2-甲基丁烷 2-甲基丁烷 | D. | 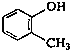 甲基苯酚 甲基苯酚 |
15.用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,向所得的溶液中加入0.1molCu(OH)2后恰好使电解液恢复到电解前的浓度和pH(不考虑CO2的溶解).则电解过程中共转移电子的物质的量为( )
| A. | 0.1mol | B. | 0.4mol | C. | 0.6mol | D. | 0.8mol |
16.下列说法正确的是( )
| A. | 0.03mol/L HA与0.03mol/L NaA等体积混合得到的碱性溶液中:c(Na+)>c(A--) | |
| B. | 酸性溶液中水的电离程度一定比纯水的电离程度小 | |
| C. | pH相等的CH3COONa、NaOH和Na2CO3三种溶液c(NaOH)<c(CH3COONa<c((Na2CO3 | |
| D. | 室温下,pH=3的CH3COOH溶液和pH=11的NaOH溶液等体积混合后,pH大于7 |