题目内容
1.下列电离方程式正确的是( )| A. | H3PO4?3H++PO43- | B. | BaSO4?Ba2++SO42- | ||
| C. | Al(OH)3?H2O+AlO2-+H+ | D. | NaHS?Na++H++S2- |
分析 用化学式和离子符号表示电离过程的式子,称为电离方程式.方程式左边写化学式,右边写离子,所有阳离子带的正电荷总数与所有阴离子所带的负电荷总数相等,离子团不能拆开,强电解质用=连接,弱电解质用?连接,
A.磷酸为多元弱酸应分步电离;
B.硫酸钡为强电解质,应用=连接;
C.氢氧化铝为两性化合物,该选项书写的是酸式电离;
D.氢硫酸为弱酸,硫氢根离子不能拆写,且应用=连接.
解答 解:A.H3PO4为多元弱酸,部分电离,电离方程式为:H3PO4?H++H2PO4-,H2PO4-?H++HPO42-,HPO42-?H++HPO43-,故A错误;
B.硫酸钡为盐,属于强电解质,完全电离,电离方程式为:BaSO4=Ba2++SO42-,故B错误;
C.氢氧化铝为两性化合物,酸式电离:Al(OH)3?H2O+AlO2-+H+,故C正确;
D.NaHS是多元弱酸的酸式盐的酸根离子,不能拆分,电离方程式为:NaHS=Na++HS-,故D错误.
故选C.
点评 本题考查了电离方程式的书写判断,掌握正确书写电离方程式的方法,并会正确判断电离方程式的正误是解题的关键,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
9.交警检测酒后驾车的原理是:2K2Cr2O7+3C2H5OH+8H2SO4═2Cr2(SO4)3+3CH3COOH+2K2SO4+11H2O(橙色的K2Cr2O7生成绿色的Cr3+).对该反应的叙述正确的是( )
| A. | 乙醇在该反应中表现为氧化性 | B. | 反应中Cr元素被还原 | ||
| C. | 该反应不是氧化还原反应 | D. | 该反应时复分解反应 |
16.下列关于苯酚的叙述中,错误的是( )
| A. | 其水溶液显强酸性,俗称石炭酸 | |
| B. | 其浓溶液对皮肤有强烈的腐蚀性,如果不慎沾在皮肤上,应立即用酒精擦洗 | |
| C. | 其在水中的溶解度随温度的升高而增大,超过65℃可以与水以任意比互溶 | |
| D. | 氯化铁溶液中滴入苯酚的水溶液后,溶液呈紫色 |
6.下列分子式表示的物质具有异构体数最多的是( )
| A. | C3H7Cl | B. | C4H8 | C. | CH2Cl2 | D. | C2H2Cl2 |
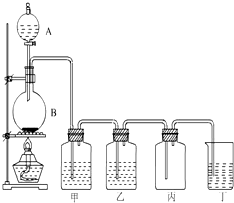
11. 如图所示一套实验装置来制取乙酸乙酯,A中盛有乙醇、浓硫酸和醋酸的混合液,C中盛有饱和碳酸钠溶液.
如图所示一套实验装置来制取乙酸乙酯,A中盛有乙醇、浓硫酸和醋酸的混合液,C中盛有饱和碳酸钠溶液.
已知:①氯化钙可与乙醇形成难溶于水的CaCl2•6C2H5OH
②有关有机物的沸点:
(1)球形管B除起冷凝作用外,另一重要作用是防止倒吸;
(2)反应中所用的乙醇是过量的,其目的是有利于酯化反应向正方向进行(增大醋酸的利用率);
(3)浓硫酸的作用是催化剂、吸收剂;
(4)从C中分离出乙酸乙酯必须使用的一种仪器是分液漏斗;分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入饱和氯化钙溶液分离出乙醇,再加入无水硫酸钠,然后进行蒸馏,收集77℃的馏分,以得到较纯净的乙酸乙酯.
(5)若实验中用含18O的乙醇与乙酸作用,则表示该反应原理的化学方程式是CH3COOH+CH3CH${\;}_{2}^{18}$OH$\stackrel{浓硫酸}{→}$CH3CO18OCH2CH3+H2O.
 如图所示一套实验装置来制取乙酸乙酯,A中盛有乙醇、浓硫酸和醋酸的混合液,C中盛有饱和碳酸钠溶液.
如图所示一套实验装置来制取乙酸乙酯,A中盛有乙醇、浓硫酸和醋酸的混合液,C中盛有饱和碳酸钠溶液.已知:①氯化钙可与乙醇形成难溶于水的CaCl2•6C2H5OH
②有关有机物的沸点:
| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点(℃) | 34.7 | 78.5 | 117.9 | 77.1 |
(2)反应中所用的乙醇是过量的,其目的是有利于酯化反应向正方向进行(增大醋酸的利用率);
(3)浓硫酸的作用是催化剂、吸收剂;
(4)从C中分离出乙酸乙酯必须使用的一种仪器是分液漏斗;分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入饱和氯化钙溶液分离出乙醇,再加入无水硫酸钠,然后进行蒸馏,收集77℃的馏分,以得到较纯净的乙酸乙酯.
(5)若实验中用含18O的乙醇与乙酸作用,则表示该反应原理的化学方程式是CH3COOH+CH3CH${\;}_{2}^{18}$OH$\stackrel{浓硫酸}{→}$CH3CO18OCH2CH3+H2O.
 如图为实验室制取氯气的装置图,请根据该图回答下列问题.
如图为实验室制取氯气的装置图,请根据该图回答下列问题.