题目内容
2.A、B混合气体在密闭容器中发生如下反应:xA(g)+yB(g)?zC(g)△H<0,达到化学平衡后测得A的浓度为0.5mol/L,在恒温下将密闭容器的容积扩大一倍,并再次达到平衡时,测得A的浓度为0.3mol/L,则下列叙述正确的是( )| A. | 平衡向右移动 | B. | x+y>z | C. | B的转化率提高 | D. | C的体积分数增加 |
分析 保持温度不变,将容器的体积扩大一倍,如平衡不移动,A的浓度为0.25mol/L,小于实际A的浓度变为0.3mol/L,说明平衡向生成A的方向移动,即向逆反应移动,据此结合选项解答.
解答 解:A、由上述分析可知,平衡向逆反应移动,故A错误;
B、增大体积,压强减小,平衡向逆反应移动,压强减小平衡向气体物质的量增大的方向移动,即x+y>z,故B正确;
C、平衡向逆反应方向移动,B的转化率降低,故C错误;
D、平衡向逆反应移动,减小压强平衡向气体物质的量增大的方向移动,气体的物质的量增大,C物质的量减小,故C的体积分数下降,故D错误;
故选B.
点评 本题考查化学平衡移动,难度中等,利用假设法判断平衡移动方向是解题关键.

练习册系列答案
 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案
相关题目
17.下列反应的离子方程式书写正确的是( )
| A. | 氯化铝溶液中加入过量的氨水:Al3++4NH3•H2O=AlO2-+4NH4++2H2O | |
| B. | 澄清石灰水与苏打溶液混合:Ca2++OH-+HCO3-=CaCO3↓+H2O | |
| C. | 氯化亚铁溶液中通入氯气:2Fe2++Cl2=2Fe3++2Cl- | |
| D. | 碳酸钙溶于醋酸:CaCO3+2H+=Ca2++CO2↑+H2O |
7.如图是硫酸试剂标签上的部分内容.下列说法正确的是( )


| A. | 配制950ml 2.3mol/LH2SO4溶液需要取该硫酸125.0mL | |
| B. | 1molAl与足量该硫酸反应产生3g氢气 | |
| C. | 该硫酸在空气中露置,溶质的质量分数会逐渐减小 | |
| D. | 该硫酸不能用来干燥二氧化硫 |
11. 如图所示一套实验装置来制取乙酸乙酯,A中盛有乙醇、浓硫酸和醋酸的混合液,C中盛有饱和碳酸钠溶液.
如图所示一套实验装置来制取乙酸乙酯,A中盛有乙醇、浓硫酸和醋酸的混合液,C中盛有饱和碳酸钠溶液.
已知:①氯化钙可与乙醇形成难溶于水的CaCl2•6C2H5OH
②有关有机物的沸点:
(1)球形管B除起冷凝作用外,另一重要作用是防止倒吸;
(2)反应中所用的乙醇是过量的,其目的是有利于酯化反应向正方向进行(增大醋酸的利用率);
(3)浓硫酸的作用是催化剂、吸收剂;
(4)从C中分离出乙酸乙酯必须使用的一种仪器是分液漏斗;分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入饱和氯化钙溶液分离出乙醇,再加入无水硫酸钠,然后进行蒸馏,收集77℃的馏分,以得到较纯净的乙酸乙酯.
(5)若实验中用含18O的乙醇与乙酸作用,则表示该反应原理的化学方程式是CH3COOH+CH3CH${\;}_{2}^{18}$OH$\stackrel{浓硫酸}{→}$CH3CO18OCH2CH3+H2O.
 如图所示一套实验装置来制取乙酸乙酯,A中盛有乙醇、浓硫酸和醋酸的混合液,C中盛有饱和碳酸钠溶液.
如图所示一套实验装置来制取乙酸乙酯,A中盛有乙醇、浓硫酸和醋酸的混合液,C中盛有饱和碳酸钠溶液.已知:①氯化钙可与乙醇形成难溶于水的CaCl2•6C2H5OH
②有关有机物的沸点:
| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点(℃) | 34.7 | 78.5 | 117.9 | 77.1 |
(2)反应中所用的乙醇是过量的,其目的是有利于酯化反应向正方向进行(增大醋酸的利用率);
(3)浓硫酸的作用是催化剂、吸收剂;
(4)从C中分离出乙酸乙酯必须使用的一种仪器是分液漏斗;分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入饱和氯化钙溶液分离出乙醇,再加入无水硫酸钠,然后进行蒸馏,收集77℃的馏分,以得到较纯净的乙酸乙酯.
(5)若实验中用含18O的乙醇与乙酸作用,则表示该反应原理的化学方程式是CH3COOH+CH3CH${\;}_{2}^{18}$OH$\stackrel{浓硫酸}{→}$CH3CO18OCH2CH3+H2O.
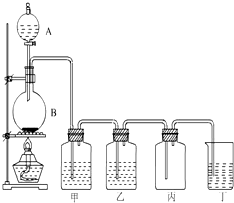 如图为实验室制取氯气的装置图,请根据该图回答下列问题.
如图为实验室制取氯气的装置图,请根据该图回答下列问题.