题目内容
【题目】下列表示正确的是( )
A.氯化镁的电子式:![]()
B.氘(2H)原子的结构示意图:
C.乙烯的结构式:CH2=CH2
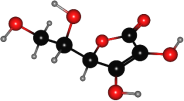
D.CO2的比例模型:![]()
【答案】B
【解析】
A.相同离子不能合并;
B.氘(2H)原子中有1个质子,核外有1个电子;
C.结构式中需要用短线代替所有的共用电子对,CH2=CH2为结构简式;
D.比例模型表示原子的相对大小及原子连接顺序、空间结构。
A.氯化镁属于离子化合物,镁离子直接用离子符号表示,氯离子需要标出最外层电子及所带电荷,氯化镁的电子式为:![]() ,故A错误;
,故A错误;
B.氘(2H)原子中有1个质子,核外有1个电子,原子结构示意图: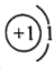 ,故B正确;
,故B正确;
C.乙烯分子中含有2个碳原子和4个氢原子,两个碳原子之间通过共用2对电子形成一个碳碳双键,碳碳键与碳氢键之间夹角120度,为平面型结构,其结构式为:![]() ,故C错误;
,故C错误;
D.二氧化碳的分子式为CO2,由模型可知小球为碳原子,2个大球为氧原子,而氧原子半径小,实际碳原子半径大于氧原子半径,二氧化碳为直线型结构,其正确的比例模型为![]() ,故D错误;
,故D错误;
故选:B。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
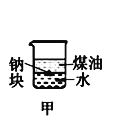
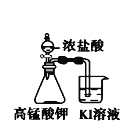
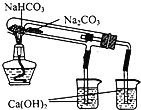
小学生10分钟应用题系列答案【题目】下列装置所示的实验中,不能达到实验目的是
|
|
|
|
A.长时间看到Fe(OH)2白色沉淀 | B.证明ρ(煤油)< ρ(钠) < ρ(水) | C.探究氧化性: KMnO4>Cl2>I2 | D.比较NaHCO3、Na2CO3的热稳定性 |
A. A B. B C. C D. D
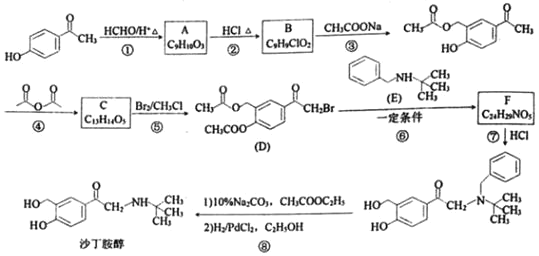
【题目】化学是一门以实验为基础的学科,实验探究能激发学生学习化学的兴趣。某化学兴趣小组设计如图实验装置(夹持设备已略)制备氯气并探究氯气及其卤族元素的性质。回答下列问题:

(1)仪器a的名称是______________。
(2)A装置中发生的化学反应方程式为_________________________________。若将漂白粉换成KClO3,则反应中每生成21.3g Cl2时转移的电子数目为____NA。
(3)装置B可用于监测实验过程中C处是否堵塞,若C处发生了堵塞,则B中可观察到__________。
(4)装置C的实验目的是验证氯气是否具有漂白性,此时C中Ⅰ、Ⅱ、Ⅲ依次可放入____(填选项a或b或c)。
选项 | Ⅰ | Ⅱ | Ⅲ |
a | 干燥的有色布条 | 浓硫酸 | 湿润的有色布条 |
b | 湿润的有色布条 | 无水氯化钙 | 干燥的有色布条 |
c | 湿润的有色布条 | 碱石灰 | 干燥的有色布条 |
(5)设计装置D、E的目的是比较氯、溴、碘的非金属性。当向D中缓缓通入足量氯气时,可观察到无色溶液逐渐变为红棕色,说明氯的非金属性大于溴,打开活塞,将D中少量溶液加入E中,振荡E,观察到的现象是_______________________________,该现象_____(填“能”或“不能”)说明溴的非金属性强于碘,原因是_____________________。
【题目】温度为T时,向2.0L恒容密闭容器中充入1.0 mol PCl5,反应PCl5(g)![]() PCl3(g)+Cl2(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:下列说法正确的是
PCl3(g)+Cl2(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:下列说法正确的是
t/s | 0 | 50 | 150 | 250 | 350 |
n(PCl3)/ mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
A.反应在前50 s的平均速率为v(PCl3)=0.0032mol·L-1·s-1
B.保持其他条件不变,升高温度,平衡时c(PCl3)=0.11mol·L-1,则反应的△H<0
C.相同温度下,起始时向容器中充入1.0mol PCl5、0.20mol PCl3和0.20molCl2,达到平衡前v(正)>v(逆)
D.相同温度下,起始时向容器中充入2.0mol PCl3和2.0molCl2,达到平衡时,PCl3的转化率小于80%