题目内容
【题目】红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。根据已知信息回答下列问题:
(1)已知:P和Cl2分两步反应生成1mol PCl5的热化学方程式:
P(s)+3/2Cl2(g)![]() PCl3(g) △H1=-306kJ/mol
PCl3(g) △H1=-306kJ/mol
Cl2(g)+PCl3(g)![]() PCl5(g) △H2=-93kJ/mol
PCl5(g) △H2=-93kJ/mol
①P和Cl2一步反应生成1molPCl5的△H3=______________ kJ/mol。
②工业上制备PCl5通常也分两步进行,通常将P和Cl2反应生成中间产物PCl3,然后降温,再和Cl2反应生成PCl5,原因是____________________________________________。
③PCl5与足量水充分反应,最终生成两种酸,其中一种是P的最高价含氧酸,其化学方程
式是________________________________________________________。
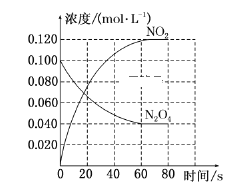
(2)反应PCl3(g)+Cl2(g)![]() PCl5(g)在容积为10L的密闭容器中进行。起始时PCl3和Cl2均为0.2mol,反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
PCl5(g)在容积为10L的密闭容器中进行。起始时PCl3和Cl2均为0.2mol,反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
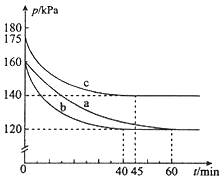
温馨提示:同温同容下的气体,压强之比就等于物质的量之比
①已知实验b平衡时气体的总物质的量为0.30mol,计算实验b反应开始至达到平衡时的反应速率v(PCl5)=_______________,PCl3的平衡转化率为__________________。
②图中3组实验从反应开始至达到平衡时的反应速率v(PCl5)由小到大的次序为____(填实验序号);与实验a相比,c组改变的实验条件是升高温度,判断依据是_________,若α表示PCl3的平衡转化率,实验a和c的平衡转化率:αa______αc(填“<”或“>”);b组改变的实验条件是加入了催化剂,判断依据是_______________________________。
③用p0表示开始时总压强,p表示平衡时总压强,则α(表示PCl3的平衡转化率)的表达式为____(用p0,p表示)。
【答案】﹣399 kJ/mol 两步反应均为放热反应,降低温度有利于提高产率,防止产物分解 PCl5+4H2O=H3PO4+5HCl v(PCl 5)=2.5×10﹣4molL﹣1min﹣1 50% acb 温度升高.反应速率加快,但平衡点向逆反应方向移动(或反应容器的容积和起始物质的量未改变,但起始总压强增大) αa >αc 加入催化剂.反应速率加快,但平衡点没有改变 2(1﹣P/P0)×100%
【解析】
(1)①根据盖斯定律,P和Cl2分两步反应和一步反应生成PCl5的△H应该是相等的,P和Cl2分两步反应生成1molPCl5的热化学方程式:P(s)+3/2Cl2(g)═PCl3(g) △H1=-306 kJ/mol;Cl2(g)+PCl3(g)═PCl5(g) △H2=-93 kJ/mol;所以P和Cl2一步反应生成1molPCl5的△H3=-306kJ/mol+(-93kJ/mol)=-399kJ/mol,故答案为:-399kJ/mol。
②P和Cl2反应生成中间产物PCl3以及三氯化磷和氯气反应生成五氯化磷这两步反应均为放热反应,生成三氯化磷后降温,再和Cl2反应生成PCl5,这样有利于提高产率,防止产物分解,故答案为:两步反应均为放热反应,降温有利于提高产率,防止产物分解。
③PCl5与足量水充分反应,最终生成两种酸:磷酸和盐酸,由原子守恒可知化学方程式为PCl5+4H2O═H3PO4+5HCl,故答案为:PCl5+4H2O═H3PO4+5HCl。
(2)①气体压强之比等于气体物质的量之比,结合化学平衡三段式列式计算,设反应的氯气物质的量为x。
PCl3(g)+Cl2(g)![]() PCl5(g)
PCl5(g)
起始量(mol) 0.2 0.2 0
变化量(mol) x x x
平衡量(mol) 0.2-x 0.2-x x
根据图象分析可知实验b气体压强160变化为120,40min达到平衡状态,气体压强之比等于气体物质的量之比,0.4:(0.4-x)=160:120,解得x=0.1mol,实验b从反应开始至达到平衡时的反应速率v(PCl5)=△c/△t=![]() =2.5×10-4mol/L·min,PCl3的平衡转化率为
=2.5×10-4mol/L·min,PCl3的平衡转化率为![]() ×100%=50%,故答案为:2.5×10-4mol/L·min,50%。
×100%=50%,故答案为:2.5×10-4mol/L·min,50%。
②分析图象可知达到平衡状态的时间不同,时间越短反应速率越快,图中3组实验从反应开始至达到平衡时的反应速率v(PCl5)由小到大的次序a<c<b,与实验a相比,b和a达到相同平衡状态,但时间不同,b组改变的实验条件及判断依据是加入了催化剂改变了反应速率;c混合气体压强增大,达到平衡时间缩短,c的反应速率比a大,但平衡转化率小于a,因此改变的条件是升高温度,反应速率大但转化率降低;ab是相同平衡状态,PCl3(g)的平衡转化率相同,反应是放热反应,c是升温,平衡逆向进行,转化率减小,αa、αc分别表示实验a和c中PCl3(g)的平衡转化率,比较其相对大小为:αa>αc,故答案为:acb;温度升高,反应速率加快,但平衡点向逆反应方向移动(或反应容器的容积和起始物质的量未改变,但起始总压强增大);αa >αc;加入催化剂.反应速率加快,但平衡点没有改变。
③由反应关系可知,反应后体系减小的体积等于生成PCl5的体积,也等于消耗PCl3的体积,![]() ,解得:α=2(1﹣P/P0)×100%,故答案为:2(1﹣P/P0)×100%。
,解得:α=2(1﹣P/P0)×100%,故答案为:2(1﹣P/P0)×100%。

 高效智能课时作业系列答案
高效智能课时作业系列答案