题目内容
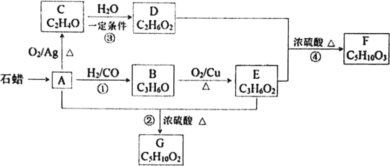
【题目】一定条件下,在密闭容器中充入CO2与H2进行反应:2CO2(g)+6H2(g) ![]() CH3OCH3(g)+3H2O(g) ΔH。采用催化剂甲和催化剂乙分别发生上述反应,测得反应进行相同时间时CO2的转化率α(CO2)随反应温度T的变化曲线如下图所示(忽略温度对催化剂活性的影响):
CH3OCH3(g)+3H2O(g) ΔH。采用催化剂甲和催化剂乙分别发生上述反应,测得反应进行相同时间时CO2的转化率α(CO2)随反应温度T的变化曲线如下图所示(忽略温度对催化剂活性的影响):
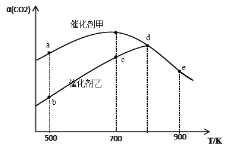
下列叙述正确的是
A. 该可逆反应的ΔH>0
B. 催化剂甲作用下反应的活化能比催化剂乙作用下反应的活化能大
C. 500K下达到平衡时,反应在催化剂甲作用下的转化率比在催化剂乙作用下的转化率高
D. d、e两点反应已经达到平衡
【答案】D
【解析】
在建立平衡之前,随着反应温度的升高,反应速率逐渐增大,随着反应的进行,CO2的转化率逐渐增大,当二氧化碳的转化率达到最大时,建立平衡,然后随着温度升高,二氧化碳的转化率减小,说明平衡逆向移动,正反应为放热反应,据此分析解答。
A.根据上述分析,该可逆反应为放热反应,ΔH<0,故A错误;
B.在建立平衡之前,相同温度条件下,催化剂甲反应速率大于催化剂乙,说明催化剂甲作用下反应的活化能比催化剂乙作用下反应的活化能小,故B错误;
C.催化剂不能使平衡发生移动,因此 500K下达到平衡时,反应在催化剂甲作用下的转化率与在催化剂乙作用下的转化率相等,故C错误;
D.根据上述分析,d、e两点反应都已经达到平衡,故D正确;
答案选D。

【题目】下表为元素周期表中的一部分,表中列出8种元素在周期表中的位置,按要求回答下列问题。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ④ | ⑥ | ||||||
3 | ① | ② | ③ | ⑤ | ⑦ | ⑧ |
(1)在①~⑧元素中化学性质最不活泼的元素的名称是____,金属性最强的元素的名称是____。
(2)③、④、⑥三种元素中的原子半径最小的是_____________(填元素符号)。
(3)①、②、③三种元素形成的离子,离子半径由大到小的顺序是____(用离子符号填写)。
(4)④与⑥形成的化合物的电子式为_____________。
(5)写出①和③两种元素的最高价氧化物对应的水化物相互反应的离子方程式:____。