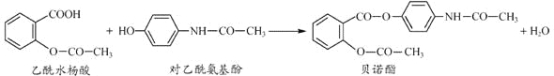
��Ŀ����
����Ŀ���¶�ΪTʱ����2.0L�����ܱ������г���1.0 mol PCl5����ӦPCl5(g)![]() PCl3(g)��Cl2(g)��һ��ʱ���ﵽƽ�⡣��Ӧ�����вⶨ�IJ������ݼ��±�������˵����ȷ����
PCl3(g)��Cl2(g)��һ��ʱ���ﵽƽ�⡣��Ӧ�����вⶨ�IJ������ݼ��±�������˵����ȷ����
t/s | 0 | 50 | 150 | 250 | 350 |
n(PCl3)/ mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
A����Ӧ��ǰ50 s��ƽ������Ϊv(PCl3)=0.0032mol��L��1��s��1
B�����������������䣬�����¶ȣ�ƽ��ʱc(PCl3)=0.11mol��L��1����Ӧ����H��0
C����ͬ�¶��£���ʼʱ�������г���1.0mol PCl5��0.20mol PCl3��0.20molCl2���ﵽƽ��ǰv(��)��v(��)
D����ͬ�¶��£���ʼʱ�������г���2.0mol PCl3��2.0molCl2���ﵽƽ��ʱ��PCl3��ת����С��80%
���𰸡�C
��������A��ɱ������ݿɵã�ǰ50sƽ������v(PCl3)=0.16mol��2.0L��50s=0.0016molL��1s��1����A����B��ɱ������ݿɵã�ԭƽ��c(PCl3)=0.20mol��2.0L=0.10molL��1����Ϊ���������������䣬�����¶ȣ��ٴ�ƽ��ʱ��c(PCl3)=0.11molL��1����������ƽ�����ƣ���H>0����B����C����ݱ�������������ʽ�ã�

����ƽ�ⳣ��K=![]() =
=![]() =0.025������ͬ�¶��£���ʼʱ�������г���1.0mol PCl5��0.20mol PCl3��0.20mol Cl2����Q=
=0.025������ͬ�¶��£���ʼʱ�������г���1.0mol PCl5��0.20mol PCl3��0.20mol Cl2����Q=![]() =
=![]() =0.02��Q<K����ʱƽ�������ƶ���v(��)>v(��)����C����D�ԭƽ��ɵ�ЧΪ��ʼ״̬Ϊ1.0mol PCl3��1.0mol Cl2��PCl3��ƽ��ת����Ϊ��1.0-0.20����1.0��100%=80%����ͬ�¶��£�����ʼʱ�������г���2.0mol PCl3��2.0mol Cl2���ﵽ��ƽ����ԭƽ�ⲻ��Ч����Ϊ����ѹǿƽ�����淴Ӧ�����ƶ�������PCl3��ת��������PCl3��ת���ʣ�80%��D��ȷ��
=0.02��Q<K����ʱƽ�������ƶ���v(��)>v(��)����C����D�ԭƽ��ɵ�ЧΪ��ʼ״̬Ϊ1.0mol PCl3��1.0mol Cl2��PCl3��ƽ��ת����Ϊ��1.0-0.20����1.0��100%=80%����ͬ�¶��£�����ʼʱ�������г���2.0mol PCl3��2.0mol Cl2���ﵽ��ƽ����ԭƽ�ⲻ��Ч����Ϊ����ѹǿƽ�����淴Ӧ�����ƶ�������PCl3��ת��������PCl3��ת���ʣ�80%��D��ȷ��