题目内容
18.下表是元素周期表的一部分,请针对表中所列标号为①~⑩的元素回答下列问题.| 族 周期 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ③ | ④ | ||||
| 三 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(2)第三周期元素除⑩外原子半径最小的是Cl(填元素符号),这些元素的最高价氧化物对应水化物中碱性最强的是NaOH(填化学式,下同),具有两性的是Al(OH)3.
(3)⑤⑥⑦单质的活泼性顺序为Na>Mg>Al (填元素符号)
分析 根据元素在周期表中的位置知,①~⑩的元素分别是C、N、O、F、Na、Mg、Al、S、Cl、Ar元素,
(1)非金属性最强的元素位于周期表右上角,但稀有气体除外;形成化合物种类最多的元素是C元素;
(2)同一周期元素,原子半径随着原子序数增大而减小;元素的金属性越强,其最高价氧化物的水化物碱性越强;呈两性的氢氧化物是氢氧化铝;
(3)同一周期元素,元素的金属性随着原子序数增大而减弱,则其金属单质的活泼性随着原子序数增大而减弱.
解答 解:根据元素在周期表中的位置知,①~⑩的元素分别是C、N、O、F、Na、Mg、Al、S、Cl、Ar元素,
(1)非金属性最强的元素位于周期表右上角,但稀有气体除外,为F元素;形成化合物种类最多的元素是C元素,故答案为:F;C;
(2)同一周期元素,原子半径随着原子序数增大而减小,所以第三周期原子半径最小的元素是Cl元素(稀有气体除外);元素的金属性越强,其最高价氧化物的水化物碱性越强,所以第三周期碱性最强的是NaOH;呈两性的氢氧化物是氢氧化铝,化学式为Al(OH)3,
故答案为:Cl;NaOH;Al(OH)3;
(3)同一周期元素,元素的金属性随着原子序数增大而减弱,则其金属单质的活泼性随着原子序数增大而减弱,所以单质活泼性顺序为Na>Mg>Al,
故答案为:Na;Mg;Al.
点评 本题考查元素周期表和元素周期律综合应用,为高频考点,熟悉元素周期表结构是解本题关键,熟练掌握同一周期、同一主族元素原子结构及其性质递变规律,题目难度不大.

练习册系列答案
 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案
相关题目
8.在一定条件下,将分別盛有熔融氯化钾、氯化镁、氧化铝的三个电解槽串联、通电、电解,一段时间后,得到钾、镁、铝的物质的量之比为( )
| A. | 1:2:3 | B. | 3:2:1 | C. | 6:3:1 | D. | 6:3:2 |
9. 影响化学反应速率的因素很多,某学校化学小组用实验的方法进行探究.他们只利用Cu、Fe、Mg和不同浓度的硫酸(0.5mol/L、2mol/L、18.4mol/L),设计实验方案来探究影响化学反应速率的因素.甲同学的实验报告如下表:
影响化学反应速率的因素很多,某学校化学小组用实验的方法进行探究.他们只利用Cu、Fe、Mg和不同浓度的硫酸(0.5mol/L、2mol/L、18.4mol/L),设计实验方案来探究影响化学反应速率的因素.甲同学的实验报告如下表:
(1)甲同学表中实验步骤②为分别投入大小、形状相同的Al、Fe、Mg.
(2)甲同学的实验目的是探究探究反应物本身的性质对反应速率的影响.
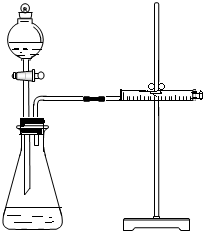
乙同学为了更精确地研究浓度对反应速率的影响,利用如图所示装置进行定量实验.
(3)乙同学在实验中应该测定的数据是测定同一金属与浓度不同但体积相同的硫酸产生一定体积的气体所需要的时间于(或在一定时间内产生气体的体积).
(4)乙同学完成实验应选用的实验药品是Mg(或Fe)和 0.5mol/L、2mol/L的硫酸.
 影响化学反应速率的因素很多,某学校化学小组用实验的方法进行探究.他们只利用Cu、Fe、Mg和不同浓度的硫酸(0.5mol/L、2mol/L、18.4mol/L),设计实验方案来探究影响化学反应速率的因素.甲同学的实验报告如下表:
影响化学反应速率的因素很多,某学校化学小组用实验的方法进行探究.他们只利用Cu、Fe、Mg和不同浓度的硫酸(0.5mol/L、2mol/L、18.4mol/L),设计实验方案来探究影响化学反应速率的因素.甲同学的实验报告如下表:| 实验步骤 | 现象 | 结论 |
| ①分别取等体积2mol/L的硫酸于试管中 ② | Mg产生气泡速率快于Fe,Cu无明显变化 | 金属性质越活泼,反应速率越快 |
(2)甲同学的实验目的是探究探究反应物本身的性质对反应速率的影响.
乙同学为了更精确地研究浓度对反应速率的影响,利用如图所示装置进行定量实验.
(3)乙同学在实验中应该测定的数据是测定同一金属与浓度不同但体积相同的硫酸产生一定体积的气体所需要的时间于(或在一定时间内产生气体的体积).
(4)乙同学完成实验应选用的实验药品是Mg(或Fe)和 0.5mol/L、2mol/L的硫酸.
6.下列有关判断正确的是( )
| A. | 反应C(s)+CO2(g)═2CO(g)的△H>0,△S<0 | |
| B. | 反应H+(aq)+OH-(aq)═H2O(l)的△H<0,△S<0 | |
| C. | 反应NH3(g)+HCl(g)═NH4Cl(s) 在低温下能自发进行,则该反应△H>0 | |
| D. | 反应CaCO3(s)═CaO(s)+CO2(g) 室温下不能自发进行,则该反应△H<0 |
13.下表是元素周期表的一部分,回答下列有关问题:
(1)写出下列元素符号:①N,⑥Si,⑦S.
(2)在①-(12)元素中,金属性最强的元素是K,非金属性最强的元素是F,最不活泼的元素是Ar.(均填元素符号)
(3)元素⑦与元素⑧相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是BD.
A.常温下⑦的单质和⑧的单质状态不同
B.⑧的氢化物比⑦的氢化物稳定
C.一定条件下⑦和⑧的单质都能与氢氧化钠溶液反应
D.⑧的最高价氧化物的水化物的酸性比⑦的最高价氧化物的水化物的酸性强.
| 族 周期 | IA | ⅡA | ⅢA | IVA | VA | VIA | VⅡA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | (11) | (12) |
(2)在①-(12)元素中,金属性最强的元素是K,非金属性最强的元素是F,最不活泼的元素是Ar.(均填元素符号)
(3)元素⑦与元素⑧相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是BD.
A.常温下⑦的单质和⑧的单质状态不同
B.⑧的氢化物比⑦的氢化物稳定
C.一定条件下⑦和⑧的单质都能与氢氧化钠溶液反应
D.⑧的最高价氧化物的水化物的酸性比⑦的最高价氧化物的水化物的酸性强.
3.下列有关化学用语使用正确的是( )
| A. | 钙离子的结构示意图: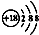 | B. | 乙烯的结构简式:CH2CH2 | ||
| C. | CH4分子的球棍模型: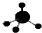 | D. | -CH3(甲基)的电子式为: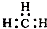 |
10.下列说法中,错误的是( )
| A. | 任何化学反应都伴随物质变化和能量变化 | |
| B. | 元素的气态氢化物的水溶液酸性越强,该元素的非金属性就越强 | |
| C. | 有些放热反应也需要加热才能发生 | |
| D. | 构成宏观物质的微观粒子之间的相互作用有多种形式,如离子键、共价键等 |
7.下列说法中正确的一组是( )
| A. | H2和D2互为同位素 | |
| B. | 金刚石、石墨和“足球稀”C60为同素异形体 | |
| C. | 碳链为 与 与 的烃为同系物 的烃为同系物 | |
| D. |  和 和 互为同分异构体 互为同分异构体 |
8.如图所示装置是化学实验室中的常用装置,它有多种用途,以下各项用途和操作都正确的是( )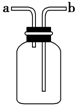

| A. | 洗气装置:瓶内放一定体积溶液,由a管口进气 | |
| B. | 收集不溶于水的气体:瓶内充满水,由b管口进气 | |
| C. | 排空气法收集氧气:由a管口进气 | |
| D. | 排空气法收集氢气:由a管口进气 |