题目内容
10.下列说法中,错误的是( )| A. | 任何化学反应都伴随物质变化和能量变化 | |
| B. | 元素的气态氢化物的水溶液酸性越强,该元素的非金属性就越强 | |
| C. | 有些放热反应也需要加热才能发生 | |
| D. | 构成宏观物质的微观粒子之间的相互作用有多种形式,如离子键、共价键等 |
分析 A、化学反应均伴随物质变化和能量变化;
B、元素的气态氢化物的水溶液的酸性与元素的非金属性强弱没有必然的关系;
C、铝热反应是放热反应,需要加热才能发生;
D、离子键、共价键、金属键都是构成宏观物质的微观粒子之间的相互作用.
解答 解:A、任何化学反应伴随物质变化,同时旧化学键断裂,新化学键形成,一定伴随能量变化,故A正确;
B、元素的气态氢化物的水溶液的酸性与元素的非金属性强弱没有必然的关系,故B错误;
C、有些放热反应也需要加热才能发生,例如铝热反应是放热反应,需要加热才能发生,故C正确;
D、离子键、共价键、金属键都是构成宏观物质的微观粒子之间的相互作用,故D正确.
故选B.
点评 本题考查学生化学反应中的能量变化知识,可以根据所学知识进行回答,难度不大.

练习册系列答案
 寒假学与练系列答案
寒假学与练系列答案
相关题目
20.下列关于晶体结构的说法不正确的是( )


| A. | 在NaCl晶体中,距Na+最近的Cl-有6个 | |
| B. | 在NaCl晶体中,每个晶胞实际拥有4个Na+、4个Cl- | |
| C. | 在金刚石晶体中,碳原子与碳碳键的数目比为1:4 | |
| D. | 在金刚石晶体中,最小环是由6个碳原子构成 |
1.硫酸工业中废渣的成分为SiO2、Fe2O3、Al2O3、MgO.某探究性学习小组的同学设计如图实验方案,将硫酸渣中金属元素转化为氢氧化物沉淀分离开来.
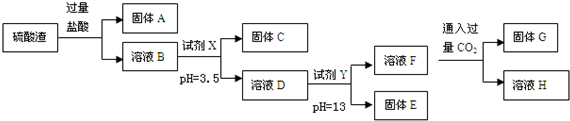
已知常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如表:
(1)固体A的化学式为SiO2.
(2)向溶液F中通过量CO2发生反应的离子方程式AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-.
(3)采用过滤操作分离固体E和溶液F,发现滤液中有少量浑浊,从实验操作的角度给出两种可能的原因:漏斗液面高于滤纸的边缘、玻璃棒下端靠在滤纸的单层处,导致滤纸破损.
(4)上述流程中的试剂Y 最好选用下列的C(填字母编号)
A、氧化镁 B、氨水 C、氢氧化钾 D、氢氧化钡
(5)取w g硫酸渣(含SiO2 m g),与 c mol 盐酸恰好完全反应,则废渣中氧元素的质量分数为8m+120c15w.(用含w、m、c的代数式表示)

已知常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如表:
| 阳离子 | Fe3+ | Al3+ | Mg2+ |
| 开始沉淀时的pH | 1.9 | 3.7 | 9.6 |
| 沉淀完全时的pH | 3.2 | 5.2 | 11.0 |
(2)向溶液F中通过量CO2发生反应的离子方程式AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-.
(3)采用过滤操作分离固体E和溶液F,发现滤液中有少量浑浊,从实验操作的角度给出两种可能的原因:漏斗液面高于滤纸的边缘、玻璃棒下端靠在滤纸的单层处,导致滤纸破损.
(4)上述流程中的试剂Y 最好选用下列的C(填字母编号)
A、氧化镁 B、氨水 C、氢氧化钾 D、氢氧化钡
(5)取w g硫酸渣(含SiO2 m g),与 c mol 盐酸恰好完全反应,则废渣中氧元素的质量分数为8m+120c15w.(用含w、m、c的代数式表示)
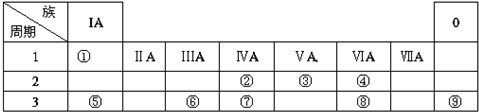
18.下表是元素周期表的一部分,请针对表中所列标号为①~⑩的元素回答下列问题.
(1)非金属性最强的元素是F(填元素符号,下同),形成化合物种类最多的元素是C.
(2)第三周期元素除⑩外原子半径最小的是Cl(填元素符号),这些元素的最高价氧化物对应水化物中碱性最强的是NaOH(填化学式,下同),具有两性的是Al(OH)3.
(3)⑤⑥⑦单质的活泼性顺序为Na>Mg>Al (填元素符号)
| 族 周期 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ③ | ④ | ||||
| 三 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(2)第三周期元素除⑩外原子半径最小的是Cl(填元素符号),这些元素的最高价氧化物对应水化物中碱性最强的是NaOH(填化学式,下同),具有两性的是Al(OH)3.
(3)⑤⑥⑦单质的活泼性顺序为Na>Mg>Al (填元素符号)
5.下列对有机物结构或性质的描述,错误的是( )
| A. | 一定条件下,Cl2 可在甲苯的苯环或侧链上发生取代反应? | |
| B. | 苯酚钠溶液中通入CO2 生成苯酚,则碳酸的酸性比苯酚弱? | |
| C. | 乙烷和丙烯混合气体的物质的量共1 mol,完全燃烧生成3 mol H2O | |
| D. | 光照下,2,2-二甲基丙烷与Br2 反应其一溴取代物只有一种 |
2. X,Y,Z三种短周期元素在周期表中的位置如图,X通过共用三对电子形成X2分子.下列说法正确的是( )
X,Y,Z三种短周期元素在周期表中的位置如图,X通过共用三对电子形成X2分子.下列说法正确的是( )
 X,Y,Z三种短周期元素在周期表中的位置如图,X通过共用三对电子形成X2分子.下列说法正确的是( )
X,Y,Z三种短周期元素在周期表中的位置如图,X通过共用三对电子形成X2分子.下列说法正确的是( )| A. | 化合物XZ3中各原子均满足8电子的稳定结构 | |
| B. | X,Y,Z三种元素形成的含氧酸都是强酸 | |
| C. | 常温下,Z单质可与Y的氢化物发生置换反应 | |
| D. | X3-与Al3+有相同的电子数,前者只有氧化性,后者只有还原性 |
 .
. ,形成的晶体是离子晶体.
,形成的晶体是离子晶体. B.CH3CH2OH
B.CH3CH2OH 乳酸 D.
乳酸 D.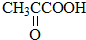 丙酮酸
丙酮酸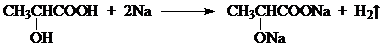 .
.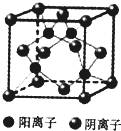 T、X、Y、Z、Q、R、W为周期表前四周期元素,原子序数依次递增.已知:
T、X、Y、Z、Q、R、W为周期表前四周期元素,原子序数依次递增.已知: