题目内容
7.下列说法中正确的一组是( )| A. | H2和D2互为同位素 | |
| B. | 金刚石、石墨和“足球稀”C60为同素异形体 | |
| C. | 碳链为 与 与 的烃为同系物 的烃为同系物 | |
| D. |  和 和 互为同分异构体 互为同分异构体 |
分析 A、H2和D2为单质,不互为同位素;
B、金刚石、石墨和“足球稀”C60都是由碳元素组成的单质,为同素异形体;
C、碳链为 与
与 的烃,前者为链状结构,后者为环状结构;
的烃,前者为链状结构,后者为环状结构;
D、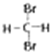 和
和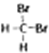 是同一物质.
是同一物质.
解答 解:A、H2和D2为单质,不互为同位素,是同一物质,故A错误;
B、金刚石、石墨和“足球稀”C60都是由碳元素组成的单质,为同素异形体,故B正确;
C、碳链为 与
与 的烃,前者为链状结构,后者为环状结构,结构不相似,不是同系物,故C错误;
的烃,前者为链状结构,后者为环状结构,结构不相似,不是同系物,故C错误;
D、 和
和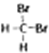 是同一物质,故D错误;
是同一物质,故D错误;
故选B.
点评 本题考查“五同”概念比较,准确掌握和理解概念是解题的关键.同素异形体是指由同一种元素形成的不同单质;具有相同的质子数不同中子数的同一元素的不同核素互为同位素;分子式相同而结构不同的化合物互称为同分异构体;结构和性质均完全相同的物质属于同一种物质.

练习册系列答案
 天天向上口算本系列答案
天天向上口算本系列答案
相关题目
17.一定温度下,在容积为2L的密闭容器中进行反应:aM(气)?bN(气).M、N的物质的量随时间的变化如图所示,下列表述中正确的是( )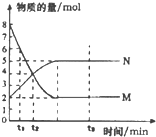

| A. | 反应式中a:b=2:5 | |
| B. | 0-t1物质M的浓度c(M)减少了1mol•L-1 | |
| C. | t2时,c(M)=c(N)=4mol•L-1,反应一定达到平衡状态 | |
| D. | t3时,c(M)不再变化,正反应速率小于逆反应速率 |
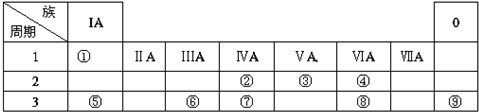
18.下表是元素周期表的一部分,请针对表中所列标号为①~⑩的元素回答下列问题.
(1)非金属性最强的元素是F(填元素符号,下同),形成化合物种类最多的元素是C.
(2)第三周期元素除⑩外原子半径最小的是Cl(填元素符号),这些元素的最高价氧化物对应水化物中碱性最强的是NaOH(填化学式,下同),具有两性的是Al(OH)3.
(3)⑤⑥⑦单质的活泼性顺序为Na>Mg>Al (填元素符号)
| 族 周期 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ③ | ④ | ||||
| 三 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(2)第三周期元素除⑩外原子半径最小的是Cl(填元素符号),这些元素的最高价氧化物对应水化物中碱性最强的是NaOH(填化学式,下同),具有两性的是Al(OH)3.
(3)⑤⑥⑦单质的活泼性顺序为Na>Mg>Al (填元素符号)
2. X,Y,Z三种短周期元素在周期表中的位置如图,X通过共用三对电子形成X2分子.下列说法正确的是( )
X,Y,Z三种短周期元素在周期表中的位置如图,X通过共用三对电子形成X2分子.下列说法正确的是( )
 X,Y,Z三种短周期元素在周期表中的位置如图,X通过共用三对电子形成X2分子.下列说法正确的是( )
X,Y,Z三种短周期元素在周期表中的位置如图,X通过共用三对电子形成X2分子.下列说法正确的是( )| A. | 化合物XZ3中各原子均满足8电子的稳定结构 | |
| B. | X,Y,Z三种元素形成的含氧酸都是强酸 | |
| C. | 常温下,Z单质可与Y的氢化物发生置换反应 | |
| D. | X3-与Al3+有相同的电子数,前者只有氧化性,后者只有还原性 |
16.下列关于催化剂的说法正确的是( )
| A. | 使用催化剂可以增大正反应速率,减小逆反应速率 | |
| B. | 使用催化剂可以使化学平衡正向移动 | |
| C. | 使用催化剂可以降低反应的活化能 | |
| D. | 使用催化剂可以改变反应的平衡常数 |
17.2014年8月3日16时30分在云南省昭通市鲁甸县(北纬27.1度,东经103.3度)发生6.5级地震,震源深度12千米,已致589人遇难.饮用水安全在灾后重建中占有极为重要的地位,某研究小组提取三处被污染的水源进行了如下分析:并给出了如下实验信息:其中一处被污染的水源含有A、B两种物质,一处含有C、D两种物质,一处含有E物质,A、B、C、D、E五种常见化合物都是由下表中的离子形成的:
为了鉴别上述化合物,分别完成以下实验,其结果是:
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;
②将E溶液滴入到C溶液中,出现白色沉淀,继续滴加沉淀溶解;
③进行焰色反应,只有B、C为紫色(透过蓝色钴玻璃);
④在各溶液中加入Ba(NO3)2溶液,再加入过量稀硝酸,A中放出无色气体,C、D中产生白色沉淀;
⑤将B、D两溶液混合,未见沉淀或气体生成.
根据上述实验现象填写下列空白:
(1)写出化学式:ANaHCO3、BKNO3、CKAl(SO4)2、DCuSO4.
(2)将含1 mol A的溶液与含1 mol E的溶液反应后蒸干,仅得到一种化合物,该化合物为Na2CO3.
(3)写出实验②发生反应的离子方程式Al3++3OH-═Al(OH)3↓、Al(OH)3+OH-═AlO2-+2H2O.
(4)C常用作净水剂,用离子方程式表示其净水原理Al3++3H2O=Al(OH)3(胶体)+3H+.
| 阳离子 | K+、Na+、Cu2+、Al3+ |
| 阴离子 | SO42-、HCO3-、NO3-、OH- |
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;
②将E溶液滴入到C溶液中,出现白色沉淀,继续滴加沉淀溶解;
③进行焰色反应,只有B、C为紫色(透过蓝色钴玻璃);
④在各溶液中加入Ba(NO3)2溶液,再加入过量稀硝酸,A中放出无色气体,C、D中产生白色沉淀;
⑤将B、D两溶液混合,未见沉淀或气体生成.
根据上述实验现象填写下列空白:
(1)写出化学式:ANaHCO3、BKNO3、CKAl(SO4)2、DCuSO4.
(2)将含1 mol A的溶液与含1 mol E的溶液反应后蒸干,仅得到一种化合物,该化合物为Na2CO3.
(3)写出实验②发生反应的离子方程式Al3++3OH-═Al(OH)3↓、Al(OH)3+OH-═AlO2-+2H2O.
(4)C常用作净水剂,用离子方程式表示其净水原理Al3++3H2O=Al(OH)3(胶体)+3H+.
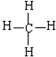 .
. ,形成的晶体是离子晶体.
,形成的晶体是离子晶体.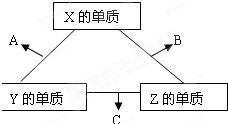
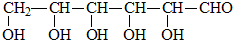 B.CH3CH2OH
B.CH3CH2OH 乳酸 D.
乳酸 D.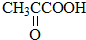 丙酮酸
丙酮酸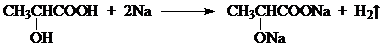 .
.