题目内容
8.在一定条件下,将分別盛有熔融氯化钾、氯化镁、氧化铝的三个电解槽串联、通电、电解,一段时间后,得到钾、镁、铝的物质的量之比为( )| A. | 1:2:3 | B. | 3:2:1 | C. | 6:3:1 | D. | 6:3:2 |
分析 三个电解槽串联,则转移的电子数相等,利用K++e-═K、Mg2++2e-═Mg、Al3++3e-═Al来计算.
解答 解:三个电解槽串联,则转移的电子数相等,设均转移6e-,
由K++e-═K、Mg2++2e-═Mg、Al3++3e-═Al,
则6e-~6K~3Mg~2Al,
所以析出钾、镁、铝的物质的量之比为6:3:2,
故选D.
点评 本题考查电解,明确电解中转移电子数的关系及电极反应式是解答本题的关键,题目难度不大.

练习册系列答案
 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案
相关题目
18.苹果酸的结构简式为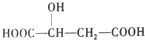 ,下列说法错误的是( )
,下列说法错误的是( )
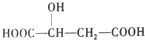 ,下列说法错误的是( )
,下列说法错误的是( )| A. | 1mol苹果酸可与2 molNaOH发生中和反应 | |
| B. | -定条件下,苹果酸与乙酸或乙醇均能发生酯化反应 | |
| C. |  与苹果酸互为同分异构体 与苹果酸互为同分异构体 | |
| D. | 1mol苹果酸与足量金属Na反应生成1.5 molH 2 |
19.可逆反应在一定条件下达到化学平衡状态的标志是( )
| A. | 反应停止了 | B. | 正反应速率与逆反应速率相等 | ||
| C. | 反应物和生成物浓度相等 | D. | 正反应速率与逆反应速率均为零 |
16.下列实验的原理分析中,正确的是( )
| A. | 将SO2通入品红溶液或者溴水都能使它们褪色,均说明SO2具有漂白性 | |
| B. | 蘸有浓氨水和蘸有浓HNO3的玻璃棒靠近时有白烟产生,是因为氨气有还原性 | |
| C. | 某溶液中滴加稀NaOH溶液,将湿润红色石蕊试纸置于试管口,试纸不变蓝,说明溶液中一定没有NH4+ | |
| D. | NH3•H2O的热不稳定性可以解释实验室中用加热氨水的办法制取氨气 |
3.下列说法正确的是( )
| A. | HA溶液的导电性较弱,则HA为弱酸 | |
| B. | S02的水溶液能导电,则S02为电解质 | |
| C. | HC1在水中能完全电离,则盐酸为强电解质 | |
| D. | BaS04是电解质,但其水溶液不导电 |
20.下列关于晶体结构的说法不正确的是( )


| A. | 在NaCl晶体中,距Na+最近的Cl-有6个 | |
| B. | 在NaCl晶体中,每个晶胞实际拥有4个Na+、4个Cl- | |
| C. | 在金刚石晶体中,碳原子与碳碳键的数目比为1:4 | |
| D. | 在金刚石晶体中,最小环是由6个碳原子构成 |
17.一定温度下,在容积为2L的密闭容器中进行反应:aM(气)?bN(气).M、N的物质的量随时间的变化如图所示,下列表述中正确的是( )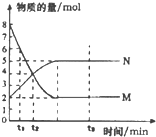

| A. | 反应式中a:b=2:5 | |
| B. | 0-t1物质M的浓度c(M)减少了1mol•L-1 | |
| C. | t2时,c(M)=c(N)=4mol•L-1,反应一定达到平衡状态 | |
| D. | t3时,c(M)不再变化,正反应速率小于逆反应速率 |
18.下表是元素周期表的一部分,请针对表中所列标号为①~⑩的元素回答下列问题.
(1)非金属性最强的元素是F(填元素符号,下同),形成化合物种类最多的元素是C.
(2)第三周期元素除⑩外原子半径最小的是Cl(填元素符号),这些元素的最高价氧化物对应水化物中碱性最强的是NaOH(填化学式,下同),具有两性的是Al(OH)3.
(3)⑤⑥⑦单质的活泼性顺序为Na>Mg>Al (填元素符号)
| 族 周期 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ③ | ④ | ||||
| 三 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(2)第三周期元素除⑩外原子半径最小的是Cl(填元素符号),这些元素的最高价氧化物对应水化物中碱性最强的是NaOH(填化学式,下同),具有两性的是Al(OH)3.
(3)⑤⑥⑦单质的活泼性顺序为Na>Mg>Al (填元素符号)
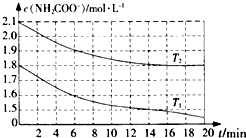 科学研究小组对氨基甲酸铵(NH2COONH4)的分解和水解反应进行探究.
科学研究小组对氨基甲酸铵(NH2COONH4)的分解和水解反应进行探究.