题目内容
13.下表是元素周期表的一部分,回答下列有关问题:| 族 周期 | IA | ⅡA | ⅢA | IVA | VA | VIA | VⅡA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | (11) | (12) |
(2)在①-(12)元素中,金属性最强的元素是K,非金属性最强的元素是F,最不活泼的元素是Ar.(均填元素符号)
(3)元素⑦与元素⑧相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是BD.
A.常温下⑦的单质和⑧的单质状态不同
B.⑧的氢化物比⑦的氢化物稳定
C.一定条件下⑦和⑧的单质都能与氢氧化钠溶液反应
D.⑧的最高价氧化物的水化物的酸性比⑦的最高价氧化物的水化物的酸性强.
分析 根据元素在周期表中的位置知,①-(12)分别是N、F、Na、Mg、Al、Si、S、Cl、Ar、K、Ca、Br元素,
(1)根据以上分析知,①是N元素,⑥是Si元素,⑦是S元素;
(2)在①-(12)元素中,金属性最强的元素位于周期表左下角,非金属性最强的元素位于周期表右上角,最不活泼的元素是稀有气体元素;
(3)元素的非金属性越强,其单质的氧化性越强、其单质与氢气化合越容易、其最高价氧化物的水化物酸性越强、氢化物的稳定性越强.
解答 解:根据元素在周期表中的位置知,①-(12)分别是N、F、Na、Mg、Al、Si、S、Cl、Ar、K、Ca、Br元素,
(1)根据以上分析知,①是N元素,⑥是Si元素,⑦是S元素,故答案为:N;Si;S;
(2)在①-(12)元素中,金属性最强的元素位于周期表左下角,为K元素,非金属性最强的元素位于周期表右上角为F元素,最不活泼的元素是稀有气体元素为Ar元素,
故答案为:K;F;Ar;
(3)元素的非金属性越强,其单质的氧化性越强、其单质与氢气化合越容易、其最高价氧化物的水化物酸性越强、氢化物的稳定性越强,
元素⑦与元素⑧相比,(用元素符号表示)非金属性较强的是Cl
A.常温下⑦的单质和⑧的单质状态不同与非金属性强弱无关,故错误;
B.⑧的氢化物比⑦的氢化物稳定,说明非金属性Cl>S,故正确;
C.一定条件下⑦和⑧的单质都能与氢氧化钠溶液反应,与金属性强弱无关,故错误;
D.⑧的最高价氧化物的水化物的酸性比⑦的最高价氧化物的水化物的酸性强,说明非金属性Cl>S,故正确;
故答案为:Cl;BD.
点评 本题考查元素周期表和元素周期律的综合应用,为高频考点,熟悉元素周期表结构及元素周期律内涵,知道非金属性强弱判断方法,不能根据得电子多少判断非金属性强弱,题目难度不大.

 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案| A. | HA溶液的导电性较弱,则HA为弱酸 | |
| B. | S02的水溶液能导电,则S02为电解质 | |
| C. | HC1在水中能完全电离,则盐酸为强电解质 | |
| D. | BaS04是电解质,但其水溶液不导电 |
| A. | NaHS水解:HS-+H2O?S2-+H3O+ | |
| B. | 向硫酸铁溶液中加入铁:Fe3++Fe═2Fe2+ | |
| C. | 在铁上镀铜阳极反应为:Cu2++2e-═Cu | |
| D. | 氯化铜水解:Cu2++2H2O?Cu(OH)2+2H+ |
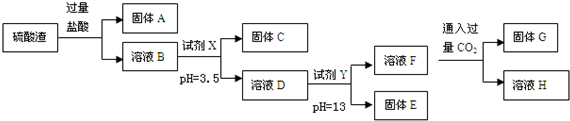
已知常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如表:
| 阳离子 | Fe3+ | Al3+ | Mg2+ |
| 开始沉淀时的pH | 1.9 | 3.7 | 9.6 |
| 沉淀完全时的pH | 3.2 | 5.2 | 11.0 |
(2)向溶液F中通过量CO2发生反应的离子方程式AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-.
(3)采用过滤操作分离固体E和溶液F,发现滤液中有少量浑浊,从实验操作的角度给出两种可能的原因:漏斗液面高于滤纸的边缘、玻璃棒下端靠在滤纸的单层处,导致滤纸破损.
(4)上述流程中的试剂Y 最好选用下列的C(填字母编号)
A、氧化镁 B、氨水 C、氢氧化钾 D、氢氧化钡
(5)取w g硫酸渣(含SiO2 m g),与 c mol 盐酸恰好完全反应,则废渣中氧元素的质量分数为$\frac{8m+120c}{15w}$.(用含w、m、c的代数式表示)
(1)常见镀铬液由重铬酸(H2Cr2O7)和催化剂硫酸组成.
①镀铬液在水溶液中存在如下平衡:Cr2O72-+H2O?2CrO42-+2H+该反应平衡常数表达式为K=$\frac{{c}^{2}(Cr{O}_{4}^{2-})•{c}^{2}({H}^{+})}{c(C{r}_{2}{O}_{7}^{2-})}$.
②镀铬时由CrO42-放电产生铬镀层.阴极的电极反应式为CrO42-+8H++6e-=Cr+4H2O.
③ABS塑料表面经处理后也可在其表面镀铬,ABS塑料的结构简式如下:
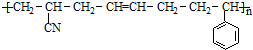 ,合成该聚合物的三种单体为:CH2=CHCN、CH2=CH-CH=CH2和
,合成该聚合物的三种单体为:CH2=CHCN、CH2=CH-CH=CH2和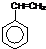 (写结构简式).
(写结构简式).(2)工业上处理含铬废水有钡盐法、电解还原法等.
Ⅰ.钡盐法处理含铬废水主要流程为:
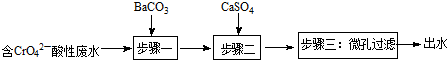
已知:
| 物质 | BaCO3 | CaSO4 | BaSO4 |
| Ksp | 8.1×10-9 | 9×10-6 | 1.1×10-10 |
②步骤二的目的是除去废水中Ba2+.
Ⅱ.电解法处理含六价铬(Cr2O72-和CrO42-)的强酸性废水,其原理如图所示.
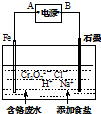
③电解一段时间后随着溶液pH的升高,便有Fe(OH)3和Cr(OH)3沉淀生成.图中A为电源正极(选填:“正”或“负”);
④阴极产生的气体为H2(写化学式).
⑤常温时Ksp[Cr(OH)3]=6.0×10-31,当废水的pH=7.0时,溶液中c(Cr3+)=6.0×10-10mol•L-1.
| 族 周期 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ③ | ④ | ||||
| 三 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(2)第三周期元素除⑩外原子半径最小的是Cl(填元素符号),这些元素的最高价氧化物对应水化物中碱性最强的是NaOH(填化学式,下同),具有两性的是Al(OH)3.
(3)⑤⑥⑦单质的活泼性顺序为Na>Mg>Al (填元素符号)
| A. | 一定条件下,Cl2 可在甲苯的苯环或侧链上发生取代反应? | |
| B. | 苯酚钠溶液中通入CO2 生成苯酚,则碳酸的酸性比苯酚弱? | |
| C. | 乙烷和丙烯混合气体的物质的量共1 mol,完全燃烧生成3 mol H2O | |
| D. | 光照下,2,2-二甲基丙烷与Br2 反应其一溴取代物只有一种 |
 X,Y,Z三种短周期元素在周期表中的位置如图,X通过共用三对电子形成X2分子.下列说法正确的是( )
X,Y,Z三种短周期元素在周期表中的位置如图,X通过共用三对电子形成X2分子.下列说法正确的是( )| A. | 化合物XZ3中各原子均满足8电子的稳定结构 | |
| B. | X,Y,Z三种元素形成的含氧酸都是强酸 | |
| C. | 常温下,Z单质可与Y的氢化物发生置换反应 | |
| D. | X3-与Al3+有相同的电子数,前者只有氧化性,后者只有还原性 |
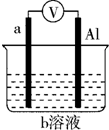 如图是某同学设计的一个简易的原电池装置,回答下列问题.
如图是某同学设计的一个简易的原电池装置,回答下列问题.