题目内容
13.A、D是生活中常见的金属单质,B、C、E、F、G、H是中学常见的6种化合物,反应①可用于焊接钢轨,相关物质间的关系如图1所示.(1)H的化学式是Fe(OH)2.
(2)反应①的化学方程式是Fe2O3+2Al$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe.
(3)反应②的离子方程式是Fe+2Fe3+=3Fe2+.
(4)电解法制D的低价氢氧化物的装置如图2.a是4mol•L-1 NaCl、1mol•L-1 NaOH的混合溶液.
①配制a时需要除去蒸馏水中溶解的O2,常采用煮沸的方法.
②石墨电极应与电源的负(填“正”或“负”)极相连接,通电后,R极附近的现象是有白色沉淀生成,R极的电极反应式是Fe+2OH--2e-=Fe(OH)2.
③实验停止一段时间后,在R极上部有红褐色物质产生,发生反应的化学方程式是4Fe(OH)2+O2+2H2O=4Fe(OH)3.
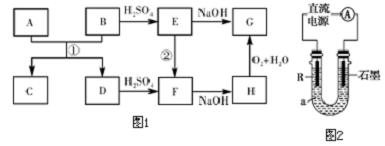
分析 A、D是生活中常见的金属单质,B、C、E、F、G、H是中学常见的6种化合物,反应①可用于焊接钢轨,则反应①为铝热反应,所以A为Al,D为Fe,C为Al2O3,B为铁的氧化物,D与硫酸反应生成F为FeSO4,F与氢氧化钠反应生成H为Fe(OH)2,H氧化得G为Fe(OH)3,所以E为Fe2(SO4)3,则B为Fe2O3,据此答题.
解答 解:A、D是生活中常见的金属单质,B、C、E、F、G、H是中学常见的6种化合物,反应①可用于焊接钢轨,则反应①为铝热反应,所以A为Al,D为Fe,C为Al2O3,B为铁的氧化物,D与硫酸反应生成F为FeSO4,F与氢氧化钠反应生成H为Fe(OH)2,H氧化得G为Fe(OH)3,所以E为Fe2(SO4)3,则B为Fe2O3,
(1)根据上面的分析可知,H的化学式是Fe(OH)2,故答案为:Fe(OH)2;
(2)反应①的化学方程式是 Fe2O3+2Al$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe,故答案为:Fe2O3+2Al$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe;
(3)反应②为硫酸铁与铁反应生成硫酸亚铁,反应的离子方程式是Fe+2Fe3+═3Fe2+,故答案为:Fe+2Fe3+=3Fe2+;
(4)①配制4mol•L-1 NaCl、1mol•L-1 NaOH的混合溶液时需要除去蒸馏水中溶解的O2,常采用煮沸的方法,故答案为:煮沸;
②电解法制Fe(OH)2时,用铁做阳极,石墨做阴极,所以石墨电极应与电源的负极相连接,通电后,在电解池的阳极附近有氢氧化亚铁产生,出现的现象是有白色沉淀生成,阳极的电极反应式是 Fe+2OH--2e-═Fe(OH)2,
故答案为:负;有白色沉淀生成;Fe+2OH--2e-=Fe(OH)2;
③实验停止一段时间后,在R极上部氢氧化亚铁被空气中的氧气氧化,有红褐色物质产生,发生反应的化学方程式是4Fe(OH)2+O2+2H2O=4Fe(OH)3,
故答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3.
点评 本题考查无机物的推断,题目难度中等,本题注意把握物质的反应特征、物质的本身特性以及工业应用为突破口进行推断,明确物质的种类为解答该题的关键.

 口算能手系列答案
口算能手系列答案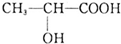 ,下列有关乳酸的说法中,不正确的是( )
,下列有关乳酸的说法中,不正确的是( )| A. | 乳酸中能发生酯化反应的官能团有2种 | |
| B. | 1 mol乳酸可与2 mol NaOH发生中和反应 | |
| C. | 1 mol乳酸与足量金属Na反应生成1 mol H2 | |
| D. | 有机物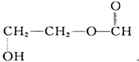 与乳酸互为同分异构体 与乳酸互为同分异构体 |
| A. | Cl- | B. | Al3+ | C. | H+ | D. | OH- |
| A. | Y形成的简单离子半径小于Z形成的简单离子半径 | |
| B. | X的氢化物稳定性弱于Y的氢化物稳定性 | |
| C. | 四种元素中,W的氧化物对应的水合物酸性最强 | |
| D. | Y与Z形成的两种化合物中所含有化学键类型相同 |
| A. | 食品保鲜膜、一次性食品袋的主要成分是聚乙烯 | |
| B. | 在家用燃煤中加入适量的生石灰能有效减少二氧化硫的排放量 | |
| C. | 若使用氯气处理水,能达到消毒杀菌和除去悬浮杂质的目的 | |
| D. | 一定浓度的双氧水可用于伤口的消毒 |
| A. | 1 L 1 mol•L-1的NaClO溶液中含有ClO-的数目为NA | |
| B. | 78 g苯含有C=C键的数目为3 NA | |
| C. | 分子数目为0.1NA的N2和NH3混合气体,原子间含有的共用电子对数目为0.3NA | |
| D. | 1 mol FeI2与足量氯气反应时转移的电子数为2 NA |
| A. | 碳酸氢钠能与碱反应,可用作食品的膨松剂 | |
| B. | 钠具有很强的还原性,可用钠与TiCl4反应制取钛 | |
| C. | Al2O3具有很高的熔点,可用于制造熔融烧碱的坩埚 | |
| D. | 铜的金属活泼性比铁强,可用于保护石油管道(碳素钢管)以减缓其腐蚀 |
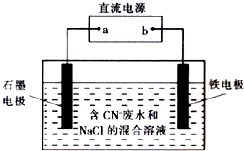 工业上,在强碱性条件下用电解法除去废水中的CN-,装置如右图所示,依次发生的反应有:
工业上,在强碱性条件下用电解法除去废水中的CN-,装置如右图所示,依次发生的反应有:①CN--2e-+2OH-═CNO-+H2O
②2Cl-一2e-═Cl2↑
③3Cl2+2CNO-+8OH-═N2+6Cl-+2CO32-+4H2O
下列说法正确的是( )
| A. | 除去1 mol CN-,外电路至少需转移5 mol电子 | |
| B. | 通电过程中溶液的pH不断增大 | |
| C. | 为了使电解池连续工作,需要不断补充NaCl | |
| D. | 铁电极上发生的反应为Fe一2e一═Fe2+ |
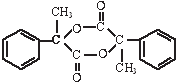 )是一种重要的化工原料,在药物、新材料等方面有重要的应用,合成该有机物的一种路线如图:
)是一种重要的化工原料,在药物、新材料等方面有重要的应用,合成该有机物的一种路线如图: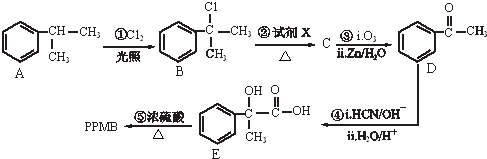
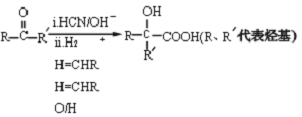
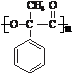 .
. .
.