题目内容
2.下列物质性质与应用对应关系正确的是( )| A. | 碳酸氢钠能与碱反应,可用作食品的膨松剂 | |
| B. | 钠具有很强的还原性,可用钠与TiCl4反应制取钛 | |
| C. | Al2O3具有很高的熔点,可用于制造熔融烧碱的坩埚 | |
| D. | 铜的金属活泼性比铁强,可用于保护石油管道(碳素钢管)以减缓其腐蚀 |
分析 A.碳酸氢钠可与碱反应不生成二氧化碳;
B.钠的金属活泼性比钛强;
C.Al2O3属于两性氢氧化物;
D.在石油管道(碳素钢管)装若干铜块,形成原电池反应,铁被腐蚀.
解答 解:A.碳酸氢钠可作食品的膨松剂,原因是与酸反应生成二氧化碳,且加热不稳定,分解生成二氧化碳气体,故A错误;
B.钠具有很强的还原性并且钠的金属活泼性比钛强,所以可用钠与TiCl4反应制取钛,故B正确;
C.Al2O3能和碱反应,不能用于制造熔融烧碱的坩埚,故C错误;
D.铁比铜活泼,在石油管道(碳素钢管)装若干铜块,形成原电池反应,铁为负极,被腐蚀,故D错误;
故选B.
点评 本题考查较为综合,涉及氧化还原反应、碳酸氢钠、Al2O3的两性等知识,为高频考点,侧重于化学于生活、生产的考查,有利于培养学生的良好的科学素养,难度不大.

练习册系列答案
 一线名师提优试卷系列答案
一线名师提优试卷系列答案
相关题目
12.下列使用漏斗的几个实验装置中,设计正确且能达到实验目的是( )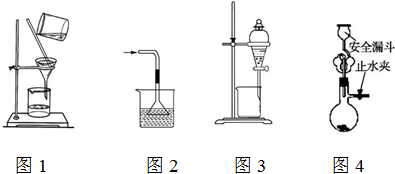

| A. | 用图1所示装置进行过滤,过滤时不断搅拌 | |
| B. | 用图2所示装置吸收NH3制氨水 | |
| C. | 用图3所示装置用苯萃取碘水中的碘,并将碘的苯溶液从漏斗下口放出 | |
| D. | 用图4所示装置用石灰石与稀盐酸制取CO2气体 |
10.分子式为C6H14O且在铜或银做催化剂的条件下,可以被空气中的氧气氧化成醛的醇有(不考虑立体异构)( )
| A. | 5种 | B. | 6种 | C. | 7种 | D. | 8种 |
17.已知:H-H、N-H、N≡N的键能分别为436KJ/mol,391KJ/mol,946KJ/mol,则:1molH2(g)与足量氮气完全反应生成NH3(g)的反应热△H(KJ/mol)为( )
| A. | +30.67 | B. | -345.3 | C. | -30.67 | D. | +345.3 |
7.下列溶液中粒子的物质的量浓度关系正确的是( )
| A. | 0.1 mol/L NaHCO3溶液与0.1 mol/L NaOH溶液等体积混合,所得溶液中:c(Na+)>c(C${{O}_{3}}^{2-}$)>c(HC${{O}_{3}}^{-}$)>c(OH-) | |
| B. | 20 mL 0.1 mol/L CH3COONa溶液与10 mL 0.1 mol/L盐酸混合后呈酸性,所得溶液中:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+) | |
| C. | 室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(Cl-)>c(H+)>c(N${{H}_{4}}^{+}$)>c(OH-) | |
| D. | 0.1 mol/L CH3COOH溶液与0.1 mol/L NaOH溶液等体积混合,所得溶液中:c(OH-)>c(H+)+c(CH3COOH) |
14.X、Y、Z、R、W是原子序数依次增大的五种短周期元素.Y和R同主族,可组成共价化合物RY2,Y和Z最外层电子数之和与W的最外层电子数相同.25℃时,0.1mol/L X和W形成化合物的水溶液pH为1.下列说法正确的是( )
| A. | Y、Z、W三种元素组成化合物的水溶液可能显碱性 | |
| B. | Z与Y、Z与W形成的化合物的化学键类型完全相同 | |
| C. | 简单离子的半径:Z>R>W>Y | |
| D. | 因非金属性Y>R,所以X与Y组成化合物的沸点低于X与R组成的化合物 |
20.下列无色溶液中,各组离子能大量共存的是( )
| A. | Ca2+、K+、Cl-、NO3- | B. | Ag+、Na+、NO3-、Cl- | ||
| C. | Cu2+、K+、SO42-、Cl- | D. | Ba2+、NH4+、SO42-、Cl- |