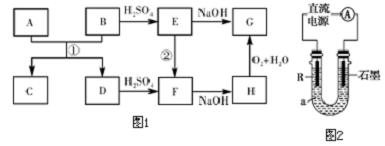
题目内容
5.设NA为阿伏加德罗常数的值,下列说法正确的是( )| A. | 1 L 1 mol•L-1的NaClO溶液中含有ClO-的数目为NA | |
| B. | 78 g苯含有C=C键的数目为3 NA | |
| C. | 分子数目为0.1NA的N2和NH3混合气体,原子间含有的共用电子对数目为0.3NA | |
| D. | 1 mol FeI2与足量氯气反应时转移的电子数为2 NA |
分析 A、ClO-是弱酸根,在溶液中会水解;
B、苯不是单双键交替的结构;
C、氮气和氨气分子中都含有3个共用电子对,0.10.1NA个混合气体中含有0.3NA个共用电子对;
D、亚铁离子和碘离子都能够被氯气氧化,1mol碘化亚铁完全反应消耗1.5mol氯气.
解答 解:A、ClO-是弱酸根,在溶液中会水解,故溶液中ClO-的个数小于NA个,故A错误;
B、苯不是单双键交替的结构,结构中不含碳碳双键,故B错误;
C、氮气和氨气分子中都含有3个共价键,则分子数0.1NA的N2和NH3混合气体,原子间含有的共用电子对数目为0.3NA,故C正确;
D、1molFeI2中含有1mol亚铁离子、2mol碘离子,完全反应需要消耗1.5mol氯气,转移了3mol电子,转移的电子数为3NA,故D错误;
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案
相关题目
15.下列反应的离子方程式正确的是( )
| A. | 过氧化钠固体与水反应制氧气:2O22-+2H2O=4OH-+O2↑ | |
| B. | 在100ml浓度为1 mol•L-1 的Fe(NO3)3的溶液中通入足量SO22Fe3++SO2+2H2O═2Fe2++SO42-+4H+ | |
| C. | 1mo•L-1 的 NaAlO2 溶液和2.5mol•L-1 的盐酸等体积混合:2AlO2-+5 H+=Al(OH)3↓+Al3++H2 O | |
| D. | 向碳酸钠溶液中逐滴加入与之等体积等物质的量浓度的稀醋酸:CO32-+H+═HCO3- |
20.有人设计出利用CH4和O2的反应,用铂电极在KOH溶液中构成燃料电池.电池的总反应类似于CH4在O2中燃烧,则下列说法正确的是( )
| A. | 每消耗1molCH4可以向外电路转移4mol电子 | |
| B. | 负极上CH4失去电子,电极反应式为CH4+10OH--8e-═CO32-+7H2O | |
| C. | 负极上是O2获得电子,电极反应式为:O2+2H2O+4e-═4OH- | |
| D. | 电池放电后,溶液pH不断升高 |
10.分子式为C6H14O且在铜或银做催化剂的条件下,可以被空气中的氧气氧化成醛的醇有(不考虑立体异构)( )
| A. | 5种 | B. | 6种 | C. | 7种 | D. | 8种 |
17.已知:H-H、N-H、N≡N的键能分别为436KJ/mol,391KJ/mol,946KJ/mol,则:1molH2(g)与足量氮气完全反应生成NH3(g)的反应热△H(KJ/mol)为( )
| A. | +30.67 | B. | -345.3 | C. | -30.67 | D. | +345.3 |
14.X、Y、Z、R、W是原子序数依次增大的五种短周期元素.Y和R同主族,可组成共价化合物RY2,Y和Z最外层电子数之和与W的最外层电子数相同.25℃时,0.1mol/L X和W形成化合物的水溶液pH为1.下列说法正确的是( )
| A. | Y、Z、W三种元素组成化合物的水溶液可能显碱性 | |
| B. | Z与Y、Z与W形成的化合物的化学键类型完全相同 | |
| C. | 简单离子的半径:Z>R>W>Y | |
| D. | 因非金属性Y>R,所以X与Y组成化合物的沸点低于X与R组成的化合物 |
3.对实验甲~丁的实验现象预测正确的是( )
| A. | 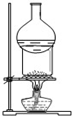 用于I2与NH4Cl混合物的分离 | B. |  可用于制取及观察Fe(OH)2 | ||
| C. | 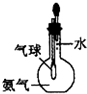 验证氨气易溶于水 | D. | 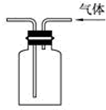 可用于排空气法收集CO2气体 |
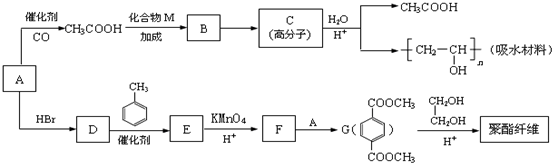
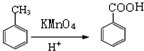
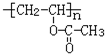 ,M的结构简式是HC≡CH,
,M的结构简式是HC≡CH,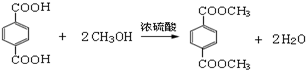 .
.