题目内容
11.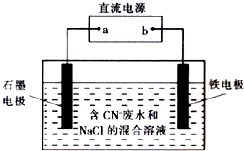 工业上,在强碱性条件下用电解法除去废水中的CN-,装置如右图所示,依次发生的反应有:
工业上,在强碱性条件下用电解法除去废水中的CN-,装置如右图所示,依次发生的反应有:①CN--2e-+2OH-═CNO-+H2O
②2Cl-一2e-═Cl2↑
③3Cl2+2CNO-+8OH-═N2+6Cl-+2CO32-+4H2O
下列说法正确的是( )
| A. | 除去1 mol CN-,外电路至少需转移5 mol电子 | |
| B. | 通电过程中溶液的pH不断增大 | |
| C. | 为了使电解池连续工作,需要不断补充NaCl | |
| D. | 铁电极上发生的反应为Fe一2e一═Fe2+ |
分析 根据发生的电极反应,可以知道金属铁是阴极,石墨电极是阳极,根据电解质中离子的放电顺序以及电极反应和电子的转移知识来回答即可.
解答 解:A、根据反应:3Cl2+2CNO-+8OH-═N2+6Cl-+2CO32-+4H2O,除去1mol CN-,消耗1.5mol氯气,转移电子3mol,根据CN--2e-+2OH-═CNO-+H2O,转移电子是2mol,所以外电路至少需转移5mol电子,故A正确;
B、根据反应①CN--2e-+2OH-═CNO-+H2O③3Cl2+2CNO-+8OH-═N2+6Cl-+2CO32-+4H2O,氢氧根离子被不断的消耗,所以通电过程中溶液pH值不断减小,故B错误;
C、根据电极反应的离子,为了使电解池连续工作,需要补充氢氧化钠和氯化钠,故C错误;
D、金属铁是阴极,阴极的电极本身不参与反应,故D错误;
故选A.
点评 本题考查学生电解池的工作原理以及电极反应式和电子转移等知识,难度不大.

练习册系列答案
 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案
相关题目
14.X、Y、Z、R、W是原子序数依次增大的五种短周期元素.Y和R同主族,可组成共价化合物RY2,Y和Z最外层电子数之和与W的最外层电子数相同.25℃时,0.1mol/L X和W形成化合物的水溶液pH为1.下列说法正确的是( )
| A. | Y、Z、W三种元素组成化合物的水溶液可能显碱性 | |
| B. | Z与Y、Z与W形成的化合物的化学键类型完全相同 | |
| C. | 简单离子的半径:Z>R>W>Y | |
| D. | 因非金属性Y>R,所以X与Y组成化合物的沸点低于X与R组成的化合物 |
16.A、B、C、D、E为原子序数依次增大的五种短周期元素,其性质或结构信息如表:
试回答以下问题:
(1)B在周期表中的位置是第二周期ⅤA族,B的氢化物与E的氢化物比较,沸点较高的是NH3(填化学式).
(2)写出D3B与甲反应所得溶液呈碱性(填“酸性”、“碱性”或“中性”),原因是(用离子方程式表示)N3-+4H2O?═?NH3•H2O+3OH-.
(3)写出丙的电子式为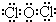 ;并说明丙的水溶液在放置过程中其酸性会增强的原因(用化学方程式表示)2HClO$\frac{\underline{\;\;△\;\;}}{\;}$2HCl+O2↑.
;并说明丙的水溶液在放置过程中其酸性会增强的原因(用化学方程式表示)2HClO$\frac{\underline{\;\;△\;\;}}{\;}$2HCl+O2↑.
(4)由A、B、C、D四种元素中的三种元素组成的一种盐丁,其外观与氯化钠相似,丁的水溶液呈碱性.
I.可用鉴别丁和氯化钠的试剂有ABC.
A.氢碘酸和淀粉的混合液 B.AgNO3溶液 C.稀硫酸
Ⅱ.将光亮的铜丝插入丁溶液中,没有现象发生,如用盐酸酸化,反应迅速发生,铜丝缓慢溶解生成深蓝色溶液,写出该反应的离子方程式Cu+2NO2-+4H+═Cu2++2NO↑+2H2O.
Ⅲ.泡菜含有多种维生素和无机盐,但也含有丁.一般情况下,当人体一次性摄取300~500mg丁时,就会引起中毒.某学习小组用碘量法测定泡菜中丁的含量.已知:2Na2S2O3+I2═Na2S4O6+2NaI.取lkg泡菜)A、B、C、D、E为原子序数依次增大的五种短周期元素,其性质或结构信息如下表:
榨汁,将榨出的液体收集后,加入提取剂和氢氧化钠,使得到的泡菜汁中的有毒无机盐都转化为丁.在过滤后的滤液中加入氢氧化铝乳液,以除去色素.再次过滤后得到滤液,将该滤液稀释至lL,取25.00mL该滤液与过量的稀硫酸和碘化钾的混合溶液反应,再选用合适的指示剂,用Na2S2O3溶液进行滴定,共消耗0.050mol•L-1Na2S2O3溶液20.00mL.请回答下列问题:
①有经验的厨师在做泡菜时往往加入适量的橙汁,以减轻丁的危害.主要是因为橙汁中含有丰富的维生素C,这说明维生素C具有还原性.
②通过计算判断某人一次食入0.125kg这种泡菜是否会引起中毒,原因是由于345mg>300mg,会引起中毒.
| 元素 | A | B | C | D | E |
| 性质或结构信息 | 室温下单质呈气态,原子最外层电子数与D相同 | D3B中阳离子与阴离子的电子层结构相同 | A和C可形成两种常见的化合物甲和乙,乙具有弱酸性 | 单质质软、银白色固体、导电性强,在空气中燃烧生成淡黄色固体 | E是一种气态氧化物丙,丙相对于空气的密度为3.0,溶于水可得只含单一溶质的弱酸性溶液,该溶液在放置过程中其酸性会增强 |
(1)B在周期表中的位置是第二周期ⅤA族,B的氢化物与E的氢化物比较,沸点较高的是NH3(填化学式).
(2)写出D3B与甲反应所得溶液呈碱性(填“酸性”、“碱性”或“中性”),原因是(用离子方程式表示)N3-+4H2O?═?NH3•H2O+3OH-.
(3)写出丙的电子式为
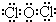 ;并说明丙的水溶液在放置过程中其酸性会增强的原因(用化学方程式表示)2HClO$\frac{\underline{\;\;△\;\;}}{\;}$2HCl+O2↑.
;并说明丙的水溶液在放置过程中其酸性会增强的原因(用化学方程式表示)2HClO$\frac{\underline{\;\;△\;\;}}{\;}$2HCl+O2↑.(4)由A、B、C、D四种元素中的三种元素组成的一种盐丁,其外观与氯化钠相似,丁的水溶液呈碱性.
I.可用鉴别丁和氯化钠的试剂有ABC.
A.氢碘酸和淀粉的混合液 B.AgNO3溶液 C.稀硫酸
Ⅱ.将光亮的铜丝插入丁溶液中,没有现象发生,如用盐酸酸化,反应迅速发生,铜丝缓慢溶解生成深蓝色溶液,写出该反应的离子方程式Cu+2NO2-+4H+═Cu2++2NO↑+2H2O.
Ⅲ.泡菜含有多种维生素和无机盐,但也含有丁.一般情况下,当人体一次性摄取300~500mg丁时,就会引起中毒.某学习小组用碘量法测定泡菜中丁的含量.已知:2Na2S2O3+I2═Na2S4O6+2NaI.取lkg泡菜)A、B、C、D、E为原子序数依次增大的五种短周期元素,其性质或结构信息如下表:
榨汁,将榨出的液体收集后,加入提取剂和氢氧化钠,使得到的泡菜汁中的有毒无机盐都转化为丁.在过滤后的滤液中加入氢氧化铝乳液,以除去色素.再次过滤后得到滤液,将该滤液稀释至lL,取25.00mL该滤液与过量的稀硫酸和碘化钾的混合溶液反应,再选用合适的指示剂,用Na2S2O3溶液进行滴定,共消耗0.050mol•L-1Na2S2O3溶液20.00mL.请回答下列问题:
①有经验的厨师在做泡菜时往往加入适量的橙汁,以减轻丁的危害.主要是因为橙汁中含有丰富的维生素C,这说明维生素C具有还原性.
②通过计算判断某人一次食入0.125kg这种泡菜是否会引起中毒,原因是由于345mg>300mg,会引起中毒.
3.对实验甲~丁的实验现象预测正确的是( )
| A. | 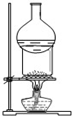 用于I2与NH4Cl混合物的分离 | B. |  可用于制取及观察Fe(OH)2 | ||
| C. | 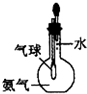 验证氨气易溶于水 | D. | 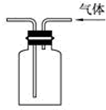 可用于排空气法收集CO2气体 |
20.下列无色溶液中,各组离子能大量共存的是( )
| A. | Ca2+、K+、Cl-、NO3- | B. | Ag+、Na+、NO3-、Cl- | ||
| C. | Cu2+、K+、SO42-、Cl- | D. | Ba2+、NH4+、SO42-、Cl- |
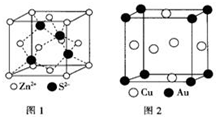 1967年舒尔滋提出金属互化物的概念,其定义为固相金属间化合物拥有两种或两种以上的金属元素,如Cu9Al4、Cu5Zn8 等.回答下列问题:
1967年舒尔滋提出金属互化物的概念,其定义为固相金属间化合物拥有两种或两种以上的金属元素,如Cu9Al4、Cu5Zn8 等.回答下列问题: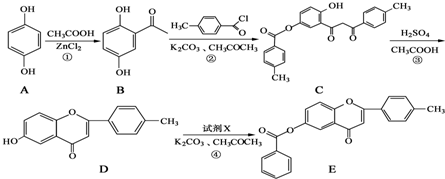
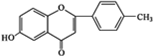 +
+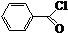 $\stackrel{K_{2}CO_{3}、CH_{3}COCH_{3}}{→}$
$\stackrel{K_{2}CO_{3}、CH_{3}COCH_{3}}{→}$ +HCl.
+HCl.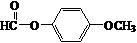 .
.