题目内容
11.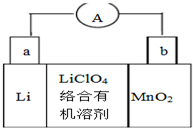 锂锰电池的体积小、性能优良,是常用的一次电池.该电池反应原理如图所示,其中电解质LiClO4.溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2.下列有关说法正确的是( )
锂锰电池的体积小、性能优良,是常用的一次电池.该电池反应原理如图所示,其中电解质LiClO4.溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2.下列有关说法正确的是( )| A. | 外电路的电流方向是由a极流向b极 | |
| B. | 电池正极反应式为MnO2+e-+Li+=LiMnO2 | |
| C. | 可用水代替电池中的混合有机溶剂 | |
| D. | 每转移0.1mol电子,理论上消耗Li的质量为3.5g |
分析 形成原电池反应时,Li为负极,被氧化,电极方程式为Li-e-=Li+,MnO2为正极,被还原,电极方程式为MnO2+e-+Li+=LiMnO2,结合电极方程式以及元素化合价的变化解答该题.
解答 解:A、Li为负极,MnO2为正极,原电池工作时,外电路的电流方向从正极到负极,即从b极流向a极,故A错误;
B、MnO2为正极,被还原,电极方程式为MnO2+e-+Li+=LiMnO2,故B正确;
C、因负极材料为Li,可与水反应,则不能用水代替电池中的混合有机溶剂,故C错误;
D、反应中Li由0价升高到+1价,即每转移0.1mol电子,理论上消耗Li的质量为0.7g,故D错误,故选B.
点评 本题侧重于电化学知识以及氧化还原反应的全面考查,题目难度适中,能很好地考查学生的分析能力、计算能力以及电化学知识的综合理解和运用,难度中等.

练习册系列答案
相关题目
2.下列对三种有机物的叙述不正确的是( )
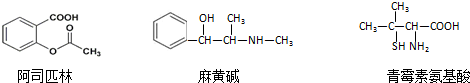

| A. | 三种有机物都能发生酯化反应 | |
| B. | 阿司匹林的苯环上的一氯代物有8种 | |
| C. | 麻黄碱的分子式是C10H15NO,苯环上的一硝基取代物有3种 | |
| D. | 青霉素氨基酸既能与盐酸反应,又能与NaOH溶液反应 |
19.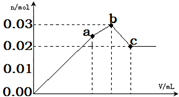 向100mL 0.1mol•L-1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1mol•L-1 Ba(OH)2溶液.随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如图所示.下列说法不正确的( )
向100mL 0.1mol•L-1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1mol•L-1 Ba(OH)2溶液.随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如图所示.下列说法不正确的( )
 向100mL 0.1mol•L-1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1mol•L-1 Ba(OH)2溶液.随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如图所示.下列说法不正确的( )
向100mL 0.1mol•L-1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1mol•L-1 Ba(OH)2溶液.随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如图所示.下列说法不正确的( )| A. | a点的溶液呈酸性的原因为:NH4++H2O?NH3•H2O+H+ | |
| B. | c点沉淀的质量比a点沉淀的质量大 | |
| C. | b点加入Ba(OH)2溶液的体积为150mL | |
| D. | 至c点完成反应,反应的离子方程式可表示为:Al3++2SO42-+NH4++2Ba2++5OH-=AlO2-+2BaSO4↓+NH3•H2O+2H2O |
6.X、Y、Z为原子序数由小到大排列的三种短周期元素.已知:X、Y的气态氢化物分子具有相同的电数;Y与Z同主族;XY2是非极性分子,其晶体可用作人工降雨.请回答:
(1)Z的最高价氧化物对应水化物W是重要的化工原料.W的化学式为H2SO4;工业制造W的生产过程主要分为三个阶段.
①101kPa时,3.2g Z的固体单质完全燃烧可放出29.7kJ的热量,写出能够表示该固体单质燃烧热的热化学方程式S(s)+O2(g)=SO2(g)△H=-297kJ/mol;
②在接触氧化阶段,为提高ZY2的转化率,从理论上判断,应选择的条件是低温和高压.从表给出不同温度、压强下ZY2平衡转化率的实验数据进行分析,结合工业生产的实际,应选择适合的温度和压强是(选填字母)B;
A.400℃~500℃10MPa B.400℃~500℃1MPa
C.500℃~500℃10MPa D.400℃~500℃0.1MPa
③在吸收阶段,为尽可能提高ZY3的吸收效率,工业上选择的吸收剂是(选填字母)C.
A.水 B.0.5mol/L的硫酸 C.98.3%的硫酸 D.浓氨水
(2)已知X与XY都是工业上常用的还原剂.
①写出X单质与W的浓溶液反应的化学方程式C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O;
②500℃,11.2L(标准状况)ZY2在催化剂作用下与XY发生化学反应.若有2×6.02×1023个电子转移时,该反应的化学方程式是SO2+2CO$\frac{\underline{催化剂}}{△}$S+2CO2.
(1)Z的最高价氧化物对应水化物W是重要的化工原料.W的化学式为H2SO4;工业制造W的生产过程主要分为三个阶段.
①101kPa时,3.2g Z的固体单质完全燃烧可放出29.7kJ的热量,写出能够表示该固体单质燃烧热的热化学方程式S(s)+O2(g)=SO2(g)△H=-297kJ/mol;
②在接触氧化阶段,为提高ZY2的转化率,从理论上判断,应选择的条件是低温和高压.从表给出不同温度、压强下ZY2平衡转化率的实验数据进行分析,结合工业生产的实际,应选择适合的温度和压强是(选填字母)B;
A.400℃~500℃10MPa B.400℃~500℃1MPa
C.500℃~500℃10MPa D.400℃~500℃0.1MPa
压强/MPa 转化率/% 温度/℃ | 0.1 | 0.5 | 1 | 10 |
| 400 | 99.2 | 99.6 | 99.7 | 99.9 |
| 500 | 93.5 | 96.9 | 97.8 | 99.3 |
| 600 | 73.7 | 85.8 | 89.5 | 96.4 |
A.水 B.0.5mol/L的硫酸 C.98.3%的硫酸 D.浓氨水
(2)已知X与XY都是工业上常用的还原剂.
①写出X单质与W的浓溶液反应的化学方程式C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O;
②500℃,11.2L(标准状况)ZY2在催化剂作用下与XY发生化学反应.若有2×6.02×1023个电子转移时,该反应的化学方程式是SO2+2CO$\frac{\underline{催化剂}}{△}$S+2CO2.
16.下列实验能达到目的是( )
| A. |  测定乙醇结构式 | B. | 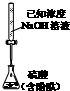 测定硫酸浓度 | ||
| C. | 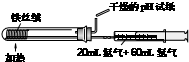 合成并检验氨 | D. | 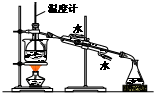 分离并回收硝基苯中的苯 |
3.火法炼铜首先要焙烧黄铜矿,其反应为:2CuFeS2+O2-→Cu2S+2FeS+SO2下列说法正确的是( )
| A. | SO2是氧化产物 | |
| B. | CuFeS2仅作还原剂,硫元素被氧化 | |
| C. | 每生成1mol Cu2S,有4mol硫被氧化 | |
| D. | 每转移1.2mol电子,有0.2mol硫被氧化 |
20.氮及其化合物在工农业生产、生活中有重要作用.请按要求回答下列相关问题:
(1)食品添加剂铵明矾NH4Al(SO4)2•12H2O高温可分解,下列关于其分解产物的预测不合理 的是C.
A.NH3、N2、SO2、H2O B.NH3、SO3、H2O
C.NH3、SO2、H2O D.NH3、N2、SO3、SO2、H2O
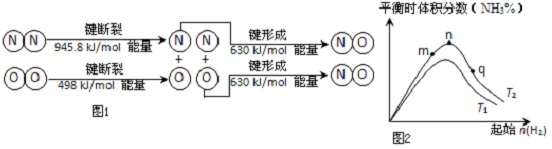
(2)汽车发动机工作时也会引发N2和O2反应产生大气污染物NO,其能量变化示意图如图1则该反应的热化学方程式为N2(g)+O2(g)=2NO(g)△H=+183.8kJ/mol.
(3)工业合成氨的反应:N2(g)+3H2(g)?2NH3(g)△H<0,分别在T1、T2温度下,改变起始氢气物质的量,测得平衡时氨的体积分数如图2所示:
①比较在m、n、q三点所处的平衡状态中,反应物N2的转化率最高的是P点.
②T2条件下,在2L的密闭容器中,充入x mol N2和 y mol H2时,3min达平衡,此时反应物的转化率均为a,写出下列仅含a、x的表达式(不必化简):v(N2)=$\frac{xa}{6}$mol•L-1•min-1;该反应的平衡常数的值K=$\frac{16(xa){\;}^{2}}{(x-xa)(3x-3xa){\;}^{3}}$.
③图象中T2低于T1(填“高于”、“低于”、“等于”或“无法确定”).
④科学家采用高质子导电性的SCY陶瓷(能传递H+ )实现氨的电化学合成,这提高了氮气和氢气的转化率.写出电化学合成过程中发生还原反应的电极方程式:N2+6H++6e-=2NH3.
(4)将质量相等的四份铁粉和铜粉的均匀混合物,分别加入同浓度稀硝酸充分反应,(假设硝酸的还原产物只有NO)实验数据如下表:
下列有关分析推断正确的是AC.
A.硝酸起始浓度为4mol/L B.①中溶解了5.6g Fe
C.③中n(Cu2+)=0.15mol D.④中V=6.72L
(1)食品添加剂铵明矾NH4Al(SO4)2•12H2O高温可分解,下列关于其分解产物的预测不合理 的是C.
A.NH3、N2、SO2、H2O B.NH3、SO3、H2O
C.NH3、SO2、H2O D.NH3、N2、SO3、SO2、H2O
(2)汽车发动机工作时也会引发N2和O2反应产生大气污染物NO,其能量变化示意图如图1则该反应的热化学方程式为N2(g)+O2(g)=2NO(g)△H=+183.8kJ/mol.
(3)工业合成氨的反应:N2(g)+3H2(g)?2NH3(g)△H<0,分别在T1、T2温度下,改变起始氢气物质的量,测得平衡时氨的体积分数如图2所示:
①比较在m、n、q三点所处的平衡状态中,反应物N2的转化率最高的是P点.
②T2条件下,在2L的密闭容器中,充入x mol N2和 y mol H2时,3min达平衡,此时反应物的转化率均为a,写出下列仅含a、x的表达式(不必化简):v(N2)=$\frac{xa}{6}$mol•L-1•min-1;该反应的平衡常数的值K=$\frac{16(xa){\;}^{2}}{(x-xa)(3x-3xa){\;}^{3}}$.
③图象中T2低于T1(填“高于”、“低于”、“等于”或“无法确定”).
④科学家采用高质子导电性的SCY陶瓷(能传递H+ )实现氨的电化学合成,这提高了氮气和氢气的转化率.写出电化学合成过程中发生还原反应的电极方程式:N2+6H++6e-=2NH3.
(4)将质量相等的四份铁粉和铜粉的均匀混合物,分别加入同浓度稀硝酸充分反应,(假设硝酸的还原产物只有NO)实验数据如下表:
| 编 号 | ① | ② | ③ | ④ |
| 稀硝酸体积/mL | 100mL | 200mL | 300mL | 400mL |
| 剩余金属/g | 18.0g | 9.6g | 0 | 0 |
| NO体积/L(标准状况下) | 2.24L | 4.48L | 6.72L | V |
A.硝酸起始浓度为4mol/L B.①中溶解了5.6g Fe
C.③中n(Cu2+)=0.15mol D.④中V=6.72L

1.钴(Co)及其化合物在工业上有广泛应用.为从某工业废料中回收钴,某学生设计流程如下(废料中含有Al、Li、Co2O3和Fe2O3等物质).
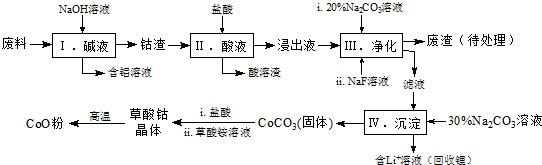
已知:①物质溶解性:LiF难溶于水,Li2CO3微溶于水;
②部分金属离子形成氢氧化物沉淀的pH见下表.
请回答:
(1)步骤Ⅰ中得到含铝溶液的反应的离子方程式是2Al+2OH-+2H2O=2AlO2-+3H2↑.
(2)写出步骤Ⅱ中Co2O3与盐酸反应生成Cl2的离子方程式:Co2O3+6H++2Cl-=2Co2++Cl2↑+3H2O.
(3)步骤Ⅲ中Na2CO3溶液的作用是调节溶液的pH,应使溶液的pH不超过7.15;废渣中的主要成分除了LiF外,还有Fe(OH)3.
(4)NaF与溶液中的Li+形成LiF沉淀,此反应对步骤Ⅳ所起的作用是降低滤液中Li+浓度,避免步骤Ⅳ中产生Li2CO3沉淀.
(5)在空气中加热5.49g草酸钴晶体(CoC2O4•2H2O)样品,受热过程中不同温度范围内分别得到一种固体物质,其质量如表.
①加热到210℃时,固体质量减轻的原因是失去结晶水.
②经测定,加热到210~290℃过程中的生成物只有CO2和钴的氧化物,此过程发生反应的化学方程式为:3CoC2O4+2O2 Co3O4+6CO2.[已知M(CoC2O4•2H2O)=183g/mol].
Co3O4+6CO2.[已知M(CoC2O4•2H2O)=183g/mol].

已知:①物质溶解性:LiF难溶于水,Li2CO3微溶于水;
②部分金属离子形成氢氧化物沉淀的pH见下表.
| Fe3+ | Co2+ | Co3+ | Al3+ | |
| pH(开始沉淀) | 1.9 | 7.15 | -0.23 | 3.4 |
| pH(完全沉淀) | 3.2 | 9.15 | 1.09 | 4.7 |
(1)步骤Ⅰ中得到含铝溶液的反应的离子方程式是2Al+2OH-+2H2O=2AlO2-+3H2↑.
(2)写出步骤Ⅱ中Co2O3与盐酸反应生成Cl2的离子方程式:Co2O3+6H++2Cl-=2Co2++Cl2↑+3H2O.
(3)步骤Ⅲ中Na2CO3溶液的作用是调节溶液的pH,应使溶液的pH不超过7.15;废渣中的主要成分除了LiF外,还有Fe(OH)3.
(4)NaF与溶液中的Li+形成LiF沉淀,此反应对步骤Ⅳ所起的作用是降低滤液中Li+浓度,避免步骤Ⅳ中产生Li2CO3沉淀.
(5)在空气中加热5.49g草酸钴晶体(CoC2O4•2H2O)样品,受热过程中不同温度范围内分别得到一种固体物质,其质量如表.
| 温度范围/℃ | 固体质量/g |
| 150~210 | 4.41 |
| 290~320 | 2.41 |
| 890~920 | 2.25 |
②经测定,加热到210~290℃过程中的生成物只有CO2和钴的氧化物,此过程发生反应的化学方程式为:3CoC2O4+2O2
 Co3O4+6CO2.[已知M(CoC2O4•2H2O)=183g/mol].
Co3O4+6CO2.[已知M(CoC2O4•2H2O)=183g/mol]. 
 +2H2O.
+2H2O.