题目内容
20.氮及其化合物在工农业生产、生活中有重要作用.请按要求回答下列相关问题:(1)食品添加剂铵明矾NH4Al(SO4)2•12H2O高温可分解,下列关于其分解产物的预测不合理 的是C.
A.NH3、N2、SO2、H2O B.NH3、SO3、H2O
C.NH3、SO2、H2O D.NH3、N2、SO3、SO2、H2O
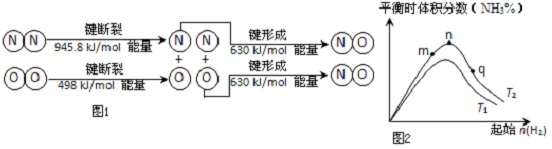
(2)汽车发动机工作时也会引发N2和O2反应产生大气污染物NO,其能量变化示意图如图1则该反应的热化学方程式为N2(g)+O2(g)=2NO(g)△H=+183.8kJ/mol.
(3)工业合成氨的反应:N2(g)+3H2(g)?2NH3(g)△H<0,分别在T1、T2温度下,改变起始氢气物质的量,测得平衡时氨的体积分数如图2所示:
①比较在m、n、q三点所处的平衡状态中,反应物N2的转化率最高的是P点.
②T2条件下,在2L的密闭容器中,充入x mol N2和 y mol H2时,3min达平衡,此时反应物的转化率均为a,写出下列仅含a、x的表达式(不必化简):v(N2)=$\frac{xa}{6}$mol•L-1•min-1;该反应的平衡常数的值K=$\frac{16(xa){\;}^{2}}{(x-xa)(3x-3xa){\;}^{3}}$.
③图象中T2低于T1(填“高于”、“低于”、“等于”或“无法确定”).
④科学家采用高质子导电性的SCY陶瓷(能传递H+ )实现氨的电化学合成,这提高了氮气和氢气的转化率.写出电化学合成过程中发生还原反应的电极方程式:N2+6H++6e-=2NH3.
(4)将质量相等的四份铁粉和铜粉的均匀混合物,分别加入同浓度稀硝酸充分反应,(假设硝酸的还原产物只有NO)实验数据如下表:
| 编 号 | ① | ② | ③ | ④ |
| 稀硝酸体积/mL | 100mL | 200mL | 300mL | 400mL |
| 剩余金属/g | 18.0g | 9.6g | 0 | 0 |
| NO体积/L(标准状况下) | 2.24L | 4.48L | 6.72L | V |
A.硝酸起始浓度为4mol/L B.①中溶解了5.6g Fe
C.③中n(Cu2+)=0.15mol D.④中V=6.72L
分析 (1)根据反应前后元素化合价变化情况是否合理来分析;
(2)根据能量变化图计算反应热,反应热=吸收的总能量-放出的总能量,再根据热化学方程式的书写规则书写;
(3)①根据平衡转化率的判断,两种或两种以上的反应物,增加其中一种物质的物质的量,提高另外一种物质的转化率,自身的转化率降低;
②利用三段式结合化学反应速率v=$\frac{△c}{△t}$,K=$\frac{c(NH{\;}_{3})^{2}}{c(N{\;}_{2}){c}^{3}(H{\;}_{2})}$进行计算;
③根据升高温度,平衡向吸热方向移动,降低温度,平衡向放热方向移动判断;
④有氧化还原知识判断反应物和生成物,根据化合价变化确定得电子数目,根据反应所处的介质补H+;
(4)由表中数据可知,实验①②都有金属剩余,则溶液中不可能含有硝酸铁,溶液中金属离子为+2价,在实验①的基础上加入100mL硝酸,参加反应的金属的质量为18g-9.6g=8.4g,生成NO的体积为4.48L-2.24L=2.24L,NO物质的量为0.1mol,根据电子转移守恒可知,参加反应金属的物质的量为$\frac{0.1mol×(5-2)}{2}$=0.15mol,参加反应金属的平均摩尔质量为$\frac{8.4g}{0.15mol}$=56g/mol,故该过程只有Fe参加反应,故实验①、②只有Fe参与反应;
在实验②的基础上加入100mL硝酸,参加反应的金属的质量为9.6g,生成NO的体积为6.72L-4.48L=2.24L,NO物质的量为0.1mol,若该过程只有Cu参加反应,根据电子转移守恒,则Cu的物质的量=$\frac{0.1mol×(5-2)}{2}$=0.15mol,Cu的质量=0.15mol×64g/mol=9.6g,等于参加反应金属的质量,故该过程只有Cu反应,且Cu恰好完全反应,所以加入200mL硝酸时Fe恰好反应生成硝酸亚铁;
在实验③的基础上再加入100mL硝酸,为硝酸与溶液中亚铁离子反应生成NO,根据亚铁离子的物质的量,利用电子转移守恒计算该阶段生成NO的物质的量,进而计算V的值.
解答 解:(1)A、生成N2,N元素化合价升高了,生成SO2,S元素化合价降低了,符合氧化还原反应原理,预测合理,故A正确;
B、生成NH3、SO3、H2O均没有化合价变化,为非氧化还原反应,预测合理,故B正确;
C、生成SO2,S元素化合价降低,生成SO3,没有元素化合价的升高,不符合氧化还原反应原理,预测不合理,故C错误;
D、既有元素化合价的升高又有元素化合价的降低,预测合理,故D正确.
故选:C;
(2)根据题意写出对应的方程式:N2(g)+O2(g)=2NO(g)△H=吸收的总能量-放出的总能量=945.8KJ/mol+498KJ/mol-2×630KJ/mol=183.8KJ/mol,
故答案为:N2(g)+O2(g)=2NO(g)△H=+183.8 kJ/mol;
(3)①根据平衡转化率的判断,两种或两种以上的反应物,增加其中一种物质的物质的量,提高另外一种物质的转化率,自身的转化率降低,故H2的物质的量越大,N2的转化率越高,所以P点的转化率最高;
故答案为:P;
②N2(g)+3H2(g)?2NH3(g)
起始浓度:$\frac{x}{2}$ $\frac{y}{2}$ 0
变化浓度:$\frac{xa}{2}$ $\frac{3xa}{2}$ xa
平衡浓度:$\frac{x-xa}{2}$ $\frac{y-3xa}{2}$ xa
因为反应物的转化率均为a,所以y=3x,
v=$\frac{△c}{△t}$=$\frac{xa}{6}$mol•L-1•min-1
K=$\frac{c(NH{\;}_{3})^{2}}{c(N{\;}_{2}){c}^{3}(H{\;}_{2})}$=$\frac{(xa){\;}^{2}}{\frac{(x-xa)}{2}×\frac{(y-3xa){\;}^{3}}{8}}$=$\frac{16(xa){\;}^{2}}{(x-xa)(3x-3xa){\;}^{3}}$
故答案为:$\frac{xa}{6}$mol•L-1•min-1;$\frac{16(xa){\;}^{2}}{(x-xa)(3x-3xa){\;}^{3}}$;
③(垂直于x轴作一条辅助线,选择H2的物质的量相同的,温度不同的两个点)假设T2>T1,升高温度有T1到T2,该反应是放热反应,
温度升高平衡逆向移动,NH3%减小,与图象所示相反,故假设错了,应该是T1>T2;
故答案为:低于;
④由题意可知:写出电化学合成过程中发生还原反应,是化合价升高的反应,从总方程式可知,N2到NH3,2个0价的N到2个-3价的N得到6个电子,
根据题目中告诉传导H+,故根据电荷守恒,式子左边不6H+,得电极反应式为N2+6H++6e-=2NH3,故答案为:N2+6H++6e-=2NH3;
(4)A、实验①中生成硝酸亚铁0.15mol,NO是0.1mol,实验根据氮原子守恒可知,参加反应的硝酸是0.15mol×2+0.1mol=0.4mol,所以稀硝酸的浓度是0.4mol÷0.1L=4mol/L,故A正确;
B、铁的金属性强于铜,所以稀硝酸首先氧化单质铁,然后再氧化单质铜.由表中数据可知,实验①②中金属均过量,所以铁的氧化产物是硝酸亚铁.实验②比实验①多溶解了18.0g-9.6g=8.4g金属,而还原产物NO多了4.48L-2.24L=2.24L,即物质的量是0.1mol,转移0.1mol×(5-2)=0.3mol.所以8.4g金属也转移0.3mol电子,因此金属的相对原子质量=8.4÷(0.3÷2)=56,这说明溶解的金属恰好是铁,因此实验①中也恰好溶解了8.4g铁,故B错误;
C、实验③比实验②多溶解了9.6g金属,多生成的NO是6.72L-4.48L=2.24L,物质的量是0.1mol,转移0.1mol×(5-2)=0.3mol.如果9.6g金属恰好是铜,则移电子$\frac{9.6g}{64g/mol}$×2=0.3mol,这说明9.6g金属就是Cu,n(Cu2+)=$\frac{0.3mol/L}{2}$=0.15mol/L,故C正确;
D.实验③中,金属去不溶解,但由于溶液中含有Fe2+,所以继续加入硝酸或继续产生NO,④中V>6.72 L,故D错误.
故答案为:AC.
点评 本题目为综合性题目,考查了热化学方程式的书写,化学平衡的三段式计算,影响化学平衡转化率的因素及给定条件下电极反应式的书写(注意反应的酸碱介质问题).特别是第(4)题,本题考查混合物的有关计算,根据表中数据判断各阶段发生的反应是解题关键,侧重对学生综合能力的考查,本题过程复杂、计算量较大,为易错题目,难度较大.

 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案| A. | 分子式为C6H12,分子结构中含有3个“-CH3”原子团的烯烃共有 5种 | |
| B. | 芥子醇(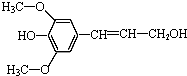 ) 能发生氧化、取代、水解、加聚反应 ) 能发生氧化、取代、水解、加聚反应 | |
| C. | 实验室制乙烯时,把生成的气体通入酸性KMnO4溶液,紫色褪去,不能说明一定生成了乙烯 | |
| D. | 将少量某物质的溶液滴加到新制银氨溶液中,水浴加热后有银镜生成,该物质不一定属于醛类 |
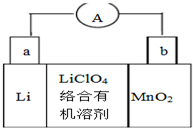 锂锰电池的体积小、性能优良,是常用的一次电池.该电池反应原理如图所示,其中电解质LiClO4.溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2.下列有关说法正确的是( )
锂锰电池的体积小、性能优良,是常用的一次电池.该电池反应原理如图所示,其中电解质LiClO4.溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2.下列有关说法正确的是( )| A. | 外电路的电流方向是由a极流向b极 | |
| B. | 电池正极反应式为MnO2+e-+Li+=LiMnO2 | |
| C. | 可用水代替电池中的混合有机溶剂 | |
| D. | 每转移0.1mol电子,理论上消耗Li的质量为3.5g |
| A. | 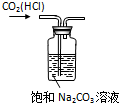 除CO2中的HCl | B. | 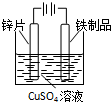 铁制品上镀锌 | C. |  吸收氨气 | D. |  制备少量O2 |
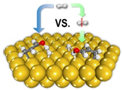 2013年《美国化学会志》发表了我国科学家对非均相催化加氢过程机理研究的成果,其原理如图.下列关于氢气的说法不正确的是( )
2013年《美国化学会志》发表了我国科学家对非均相催化加氢过程机理研究的成果,其原理如图.下列关于氢气的说法不正确的是( )| A. | 由氢原子构成的氢气分子只有一种 | |
| B. | 通常情况下,气体中氢气的密度最小 | |
| C. | 氢气可用于生产盐酸、氨气等化工产品 | |
| D. | 目前,工业上不采用电解水的方法大量生产氢气 |
 已知砷(As)元素的原子结构示意图为
已知砷(As)元素的原子结构示意图为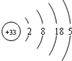
 .
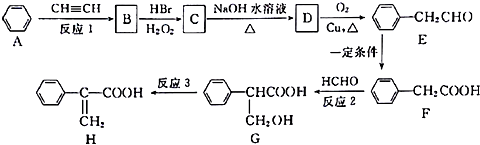
. +NaOH $→_{△}^{水}$
+NaOH $→_{△}^{水}$ +NaBr.
+NaBr. .
.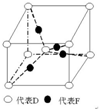 在元素周期表前四周期中原子序数依次增大的六种元素A、B、C、D、E、F中,A与其余五种元素既不同周期也不同主族,B的一种核素在考古时常用来鉴定一些文物的年代,C的氧化物是导致酸雨的主要物质之一,D原子核外电子有8种不同的运动状态,E的基态原子在前四周期元素的基态原子中单电子数最多,F元素的基态原子最外能层只有一个电子,其它能层均已充满电子.
在元素周期表前四周期中原子序数依次增大的六种元素A、B、C、D、E、F中,A与其余五种元素既不同周期也不同主族,B的一种核素在考古时常用来鉴定一些文物的年代,C的氧化物是导致酸雨的主要物质之一,D原子核外电子有8种不同的运动状态,E的基态原子在前四周期元素的基态原子中单电子数最多,F元素的基态原子最外能层只有一个电子,其它能层均已充满电子. ; A2D由液态形成晶体时密度减小(填增大,不变或减小),分析主要原因(用文字叙述)水形成晶体时,每个水分子与4个水分子形成氢键,构成空间正四面体网状结构,水分子空间利用率低,密度反而减小.
; A2D由液态形成晶体时密度减小(填增大,不变或减小),分析主要原因(用文字叙述)水形成晶体时,每个水分子与4个水分子形成氢键,构成空间正四面体网状结构,水分子空间利用率低,密度反而减小.