题目内容
19.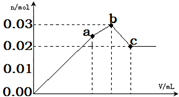 向100mL 0.1mol•L-1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1mol•L-1 Ba(OH)2溶液.随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如图所示.下列说法不正确的( )
向100mL 0.1mol•L-1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1mol•L-1 Ba(OH)2溶液.随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如图所示.下列说法不正确的( )| A. | a点的溶液呈酸性的原因为:NH4++H2O?NH3•H2O+H+ | |
| B. | c点沉淀的质量比a点沉淀的质量大 | |
| C. | b点加入Ba(OH)2溶液的体积为150mL | |
| D. | 至c点完成反应,反应的离子方程式可表示为:Al3++2SO42-+NH4++2Ba2++5OH-=AlO2-+2BaSO4↓+NH3•H2O+2H2O |
分析 100mL 0.1mol•L-1硫酸铝铵[NH4Al(SO4)2],NH4Al(SO4)2物质的量为0.01mol.溶液含有NH4+0.01mol,Al3+0.01mol,SO42-0.02mol.
开始滴加同时发生反应为SO42-+Ba2+=BaSO4↓,Al3++3OH-=Al(OH)3↓,当Al3+沉淀完全时需加入0.03molOH-,即加入0.015molBa(OH)2,加入的Ba2+为0.015mol,SO42-未完全沉淀,此时溶液含有硫酸铵;(开始到a)再滴加Ba(OH)2,生成BaSO4沉淀,发生反应为SO42-+Ba2+=BaSO4↓,NH4++OH-=NH3?H2O,所以沉淀质量继续增加;当SO42-完全沉淀时,共需加入0.02molBa(OH)2,加入0.04molOH-,Al3+反应掉0.03molOH-,生成Al(OH)30.01mol,剩余0.01molOH-恰好与NH4+完全反应,此时溶液中NH4+完全反应,此时溶液为氨水溶液;(a到b)
继续滴加Ba(OH)2,Al(OH)3溶解,发生反应Al(OH)3+OH-=AlO2-+2H2O,由方程式可知要使0.01molAl(OH)3完全溶解,需再加入0.005molBa(OH)2,此时溶液为氨水与偏铝酸钡溶液.(b到c)
解答 解:100mL 0.1mol•L-1硫酸铝铵[NH4Al(SO4)2],NH4Al(SO4)2物质的量为0.01mol.溶液含有NH4+0.01mol,Al3+0.01mol,SO42-0.02mol.
开始滴加同时发生反应为SO42-+Ba2+=BaSO4↓,Al3++3OH-=Al(OH)3↓,当Al3+沉淀完全时需加入0.03molOH-,即加入0.015molBa(OH)2,加入的Ba2+为0.015mol,SO42-未完全沉淀,此时溶液含有硫酸铵;再滴加Ba(OH)2,生成BaSO4沉淀,发生反应为SO42-+Ba2+=BaSO4↓,NH4++OH-=NH3?H2O,所以沉淀质量继续增加,但增加幅度较前一过程小;当SO42-完全沉淀时,共需加入0.02molBa(OH)2,加入0.04molOH-,Al3+反应掉0.03molOH-,生成Al(OH)30.01mol,剩余0.01molOH-恰好与NH4+完全反应,此时溶液中NH4+完全反应,此时溶液为氨水溶液,沉淀达最大为BaSO4和Al(OH)3;继续滴加Ba(OH)2,Al(OH)3溶解,发生反应Al(OH)3+OH-=AlO2-+2H2O,由方程式可知要使0.01molAl(OH)3完全溶解,需再加入0.005molBa(OH)2,此时溶液为氨水与偏铝酸钡溶液.
A、由分析可知,从开始到a点,发生反应为SO42-+Ba2+=BaSO4↓,Al3++3OH-=Al(OH)3↓,a点对应的沉淀为BaSO4和Al(OH)3,溶液的溶质是(NH4)2SO4,那么该物质水解溶液呈酸性,其原因为:NH4++H2O?NH3•H2O+H+,故A正确;
B、a点沉淀的质量=0.015mol×233g/mol+0.01mol×78g/mol=4.275g,c点为硫酸钡的质量,为0.01mol×2×233g/mol=4.66g,所以质量c点>a点,故B正确;
C、当SO42-完全沉淀时,共需加入0.02molBa(OH)2,则b点消耗氢氧化钡体积=$\frac{0.02mol}{0.1mol/L}$=200mL,故C错误;
D、至c点完成反应,反应的离子方程式可表示为:Al3++2SO42-+NH4++2Ba2++5OH-=AlO2-+2BaSO4↓+NH3•H2O+2H2O,故D正确;
故选:C.
点评 本题考查铝化合物的性质及计算,难度比较大,清楚整个反应过程是解题的关键,注意NH4+与Al3+同时存在,OH-首先与Al3+反应,而NH4+与Al(OH)3同时存在,OH-首先与NH4+反应.

 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案| A. | 地球上CH4、CO2等气体含量上升容易导致温室效应加剧,进而引发灾难性气候 | |
| B. | 大量焚烧田间秸秆会产生雾霾,“雾”和“霾”为不同类别的分散系 | |
| C. | 太阳光分解水制氢气、植物秸秆制沼气、高粱制乙醇都涉及到生物质能的利用 | |
| D. | PbO2具有氧化性和导电性,可用作铅蓄电池正极材料 |
| A. | 分子式为C6H12,分子结构中含有3个“-CH3”原子团的烯烃共有 5种 | |
| B. | 芥子醇(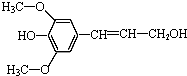 ) 能发生氧化、取代、水解、加聚反应 ) 能发生氧化、取代、水解、加聚反应 | |
| C. | 实验室制乙烯时,把生成的气体通入酸性KMnO4溶液,紫色褪去,不能说明一定生成了乙烯 | |
| D. | 将少量某物质的溶液滴加到新制银氨溶液中,水浴加热后有银镜生成,该物质不一定属于醛类 |
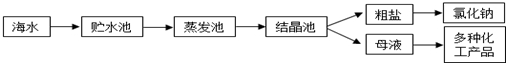
(1)①粗盐中含有Ca2+、Mg2+、SO42-等杂质,精制时所用试剂为:A:盐酸;B:BaCl2溶液;C:NaOH溶液;D:Na2CO3溶液.加入试剂的顺序是CBDA或BCDA.
②电解饱和食盐水时,与电源正极相连的电极上发生的反应为2Cl--2e-=Cl2↑,与电源负极相连的电极附近溶液pH的变化是变大.
(2)工业上从海水中提取的NaCl,可用来制取纯碱,其简要过程如下:向饱和食盐水中先通入气体A,后通入气体B,充分反应后过滤得到晶体C和滤液D,将晶体C灼烧即可制得纯碱,则气体B是CO2(填化学式),由NaCl制取纯碱反应的化学方程为NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl、2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O.
(3)海水提镁的一段工艺流程如图:
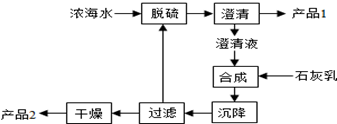
浓海水的主要成分如下:
| 离子 | Na+ | Mg2+ | Cl- | SO42- |
| 浓度/(g•L-1) | 63.7 | 28.8 | 144.6 | 46.4 |
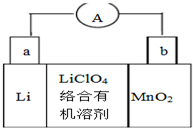 锂锰电池的体积小、性能优良,是常用的一次电池.该电池反应原理如图所示,其中电解质LiClO4.溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2.下列有关说法正确的是( )
锂锰电池的体积小、性能优良,是常用的一次电池.该电池反应原理如图所示,其中电解质LiClO4.溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2.下列有关说法正确的是( )| A. | 外电路的电流方向是由a极流向b极 | |
| B. | 电池正极反应式为MnO2+e-+Li+=LiMnO2 | |
| C. | 可用水代替电池中的混合有机溶剂 | |
| D. | 每转移0.1mol电子,理论上消耗Li的质量为3.5g |
| A. | 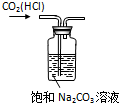 除CO2中的HCl | B. | 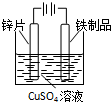 铁制品上镀锌 | C. |  吸收氨气 | D. |  制备少量O2 |
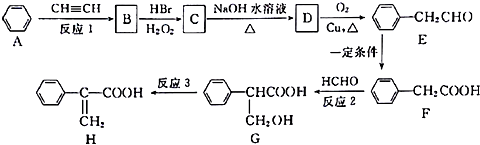
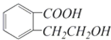 它可通过不同的反应分别得到下列物质:
它可通过不同的反应分别得到下列物质:
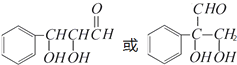 .(注:同一碳原子上连两个或两个以上羟基不稳定,故书写时排除此类化合物.)
.(注:同一碳原子上连两个或两个以上羟基不稳定,故书写时排除此类化合物.)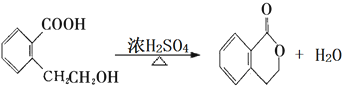 .
.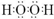 .
.
 .
. +NaOH $→_{△}^{水}$
+NaOH $→_{△}^{水}$ +NaBr.
+NaBr. .
.