题目内容
16.下列实验能达到目的是( )| A. |  测定乙醇结构式 | B. | 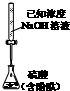 测定硫酸浓度 | ||
| C. | 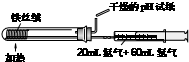 合成并检验氨 | D. | 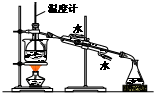 分离并回收硝基苯中的苯 |
分析 A.乙醇与钠反应生成氢气,根据氢气的体积可确定一定乙醇生成氢气的量,以此可确定乙醇是否含有羟基;
B.氢氧化钠应放在碱式滴定管中;
C.应用湿润的pH试纸;
D.温度计应用于测量馏分的温度.
解答 解:A.乙醇与钠反应生成氢气,根据氢气的体积可确定一定乙醇生成氢气的量,以此可确定乙醇是否含有羟基,可完成实验,故A正确;
B.氢氧化钠具有腐蚀性,可腐蚀玻璃,应放在碱式滴定管中,故B错误;
C.氨水溶液呈碱性,应用湿润的pH试纸,故C错误;
D.为蒸馏操作,温度计应位于蒸馏烧瓶的支管口附近,用于测量馏分的温度,故D错误.
故选A.
点评 本题考查化学实验方案的评价,为高频考点,涉及实验原理、滴定、气体的检验以及物质的制备等知识,把握物质的性质、反应原理、实验基本技能为解答的关键,侧重实验评价分析的考查,注意实验装置的作用,题目难度不大.

练习册系列答案
相关题目
6.在0.1mol•L-1CH3COOH溶液中存在如下电离平衡:CH3COOH?CH3COO-+H+,对于该平衡,下列叙述不正确的是( )
| A. | 加水稀释,电离平衡正向移动,溶液中n(H+)减小 | |
| B. | 加热,电离平衡正向移动,溶液中c(CH3COO-)增大 | |
| C. | 通入少量HCl气体,电离平衡逆向移动,溶液中c(H+)减小 | |
| D. | 加入少量CH3COONa固体,电离平衡逆向移动,溶液中c(H+)减小 |
7.海水是巨大的资源宝库,利用海水提取食盐的过程如图所示.回答下列问题:
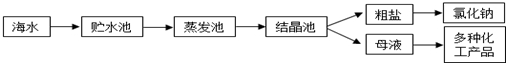
(1)①粗盐中含有Ca2+、Mg2+、SO42-等杂质,精制时所用试剂为:A:盐酸;B:BaCl2溶液;C:NaOH溶液;D:Na2CO3溶液.加入试剂的顺序是CBDA或BCDA.
②电解饱和食盐水时,与电源正极相连的电极上发生的反应为2Cl--2e-=Cl2↑,与电源负极相连的电极附近溶液pH的变化是变大.
(2)工业上从海水中提取的NaCl,可用来制取纯碱,其简要过程如下:向饱和食盐水中先通入气体A,后通入气体B,充分反应后过滤得到晶体C和滤液D,将晶体C灼烧即可制得纯碱,则气体B是CO2(填化学式),由NaCl制取纯碱反应的化学方程为NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl、2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O.
(3)海水提镁的一段工艺流程如图:
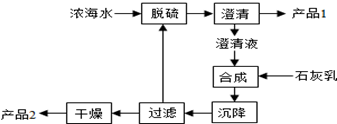
浓海水的主要成分如下:
该工艺过程中,脱硫阶段主要反应的离子方程式为Ca2++SO42-=CaSO4↓,1L浓海水最多可得到产品2的物质的量为1.2mol.

(1)①粗盐中含有Ca2+、Mg2+、SO42-等杂质,精制时所用试剂为:A:盐酸;B:BaCl2溶液;C:NaOH溶液;D:Na2CO3溶液.加入试剂的顺序是CBDA或BCDA.
②电解饱和食盐水时,与电源正极相连的电极上发生的反应为2Cl--2e-=Cl2↑,与电源负极相连的电极附近溶液pH的变化是变大.
(2)工业上从海水中提取的NaCl,可用来制取纯碱,其简要过程如下:向饱和食盐水中先通入气体A,后通入气体B,充分反应后过滤得到晶体C和滤液D,将晶体C灼烧即可制得纯碱,则气体B是CO2(填化学式),由NaCl制取纯碱反应的化学方程为NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl、2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O.
(3)海水提镁的一段工艺流程如图:

浓海水的主要成分如下:
| 离子 | Na+ | Mg2+ | Cl- | SO42- |
| 浓度/(g•L-1) | 63.7 | 28.8 | 144.6 | 46.4 |
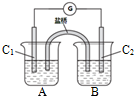
11.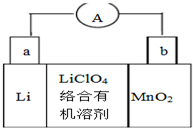 锂锰电池的体积小、性能优良,是常用的一次电池.该电池反应原理如图所示,其中电解质LiClO4.溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2.下列有关说法正确的是( )
锂锰电池的体积小、性能优良,是常用的一次电池.该电池反应原理如图所示,其中电解质LiClO4.溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2.下列有关说法正确的是( )
 锂锰电池的体积小、性能优良,是常用的一次电池.该电池反应原理如图所示,其中电解质LiClO4.溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2.下列有关说法正确的是( )
锂锰电池的体积小、性能优良,是常用的一次电池.该电池反应原理如图所示,其中电解质LiClO4.溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2.下列有关说法正确的是( )| A. | 外电路的电流方向是由a极流向b极 | |
| B. | 电池正极反应式为MnO2+e-+Li+=LiMnO2 | |
| C. | 可用水代替电池中的混合有机溶剂 | |
| D. | 每转移0.1mol电子,理论上消耗Li的质量为3.5g |
1.将0.2moL/L的CH3COONa溶液与0.1mol/L的硝酸溶液等体积混合后,溶液中下列粒子的物质的量浓度的关系正确的是( )
| A. | c(CH3COO-)+c(NO3-)+c(OH-)=c(H+)+c(Na+) | |
| B. | c(CH3COO-)=c(Na+)=c(NO3-)>c(CH3COOH)>c(H+)>c(Na+) | |
| C. | c(CH3COO-)>c(NO3-)>c(CH3COOH)=c(Na+)>c(H+)>c(OH-) | |
| D. | c(Na+)>c(NO3-)>c(CH3COO-)>c(CH3COOH)>c(H+)>c(OH-) |
8.下列实验装置、试剂选用或操作正确的是( )
| A. | 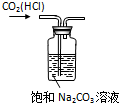 除CO2中的HCl | B. | 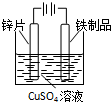 铁制品上镀锌 | C. |  吸收氨气 | D. |  制备少量O2 |
6.有五种短周期主族元素X、Y、Z、W、Q,其中Q的单质是密度最小的气体,X原子的最外层电子数是内层电子数的2倍,Y和W同主族且原子序数之比为2:1,Z是短周期中原子半径最大的元素.下列叙述错误的是( )
| A. | XQ2W分子在常温下呈气态,分子中的四个原子在同一平面内 | |
| B. | Z和W形成的两种离子化合物中阴、阳离子个数比均为2:1 | |
| C. | X、W两元素分别和Q元素化合,可形成电子数相同的两种化合物 | |
| D. | 相应的离子半径大小关系为:Y>W>Z |
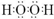 .
.
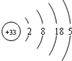
 已知砷(As)元素的原子结构示意图为
已知砷(As)元素的原子结构示意图为