题目内容
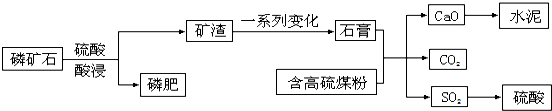
6.X、Y、Z为原子序数由小到大排列的三种短周期元素.已知:X、Y的气态氢化物分子具有相同的电数;Y与Z同主族;XY2是非极性分子,其晶体可用作人工降雨.请回答:(1)Z的最高价氧化物对应水化物W是重要的化工原料.W的化学式为H2SO4;工业制造W的生产过程主要分为三个阶段.
①101kPa时,3.2g Z的固体单质完全燃烧可放出29.7kJ的热量,写出能够表示该固体单质燃烧热的热化学方程式S(s)+O2(g)=SO2(g)△H=-297kJ/mol;
②在接触氧化阶段,为提高ZY2的转化率,从理论上判断,应选择的条件是低温和高压.从表给出不同温度、压强下ZY2平衡转化率的实验数据进行分析,结合工业生产的实际,应选择适合的温度和压强是(选填字母)B;
A.400℃~500℃10MPa B.400℃~500℃1MPa
C.500℃~500℃10MPa D.400℃~500℃0.1MPa
压强/MPa 转化率/% 温度/℃ | 0.1 | 0.5 | 1 | 10 |
| 400 | 99.2 | 99.6 | 99.7 | 99.9 |
| 500 | 93.5 | 96.9 | 97.8 | 99.3 |
| 600 | 73.7 | 85.8 | 89.5 | 96.4 |
A.水 B.0.5mol/L的硫酸 C.98.3%的硫酸 D.浓氨水
(2)已知X与XY都是工业上常用的还原剂.
①写出X单质与W的浓溶液反应的化学方程式C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O;
②500℃,11.2L(标准状况)ZY2在催化剂作用下与XY发生化学反应.若有2×6.02×1023个电子转移时,该反应的化学方程式是SO2+2CO$\frac{\underline{催化剂}}{△}$S+2CO2.
分析 X、Y、Z为原子序数由小到大排列的三种短周期元素.已知:X、Y的气态氢化物分子具有相同的电子数,XY2是非极性分子,其晶体可用作人工降雨,则是CO2,故X为碳元素,Y为氧元素;Y与Z同主族;则Z为硫元素.
(1)Z的最高价氧化物对应水化物W是硫酸(H2SO4).
①在101kPa时,3.2g硫的物质的量为0.1mol,0.1mol硫单质完全燃烧可放出29.7kJ的热量,所以1mol硫单质完全燃烧可放出297kJ的热量,据此书写单质燃烧热的热化学方程式.注意书写热化学反应方程式,可燃物的物质的量为1mol.
②增大压强后,SO2的平衡转化率提高得并不多,加压对设备的要求高且耗能多,将增大投资和能量消耗.
400℃~500℃作为操作温度,因为在这个温度范围内,催化剂的活性(反应速率)和SO2的平衡转化率都比较理想.
③由于反应SO3+H2O=H2SO4是一个放热反应,如果用水或稀硫酸吸收SO3,放出的热量会使溶液形成大量的酸雾,不利于SO3的吸收,所以工业上用98.3%的浓硫酸吸收SO3,然后在水或稀硫酸中稀释浓硫酸,制得各种浓度的硫酸产品.
(2)①碳与浓硫酸反应生成二氧化碳、二氧化硫、水.据此书写方程式.
②11.2L(标准状况)SO2的物质的量0.5mol,催化剂作用下与CO发生化学反应,有2×6.02×1023个电子转移时,根据电子转移守恒可知硫元素被还原到硫单质.
解答 解:X、Y、Z为原子序数由小到大排列的三种短周期元素.已知:X、Y的气态氢化物分子具有相同的电子数,XY2是非极性分子,其晶体可用作人工降雨,则是CO2,故X为碳元素,Y为氧元素;Y与Z同主族;则Z为硫元素.
(1)Z的最高价氧化物对应水化物W是硫酸化学式为H2SO4.故答案为:H2SO4;
①在101kPa时,3.2g硫的物质的量为0.1mol,0.1mol硫单质完全燃烧可放出29.7kJ的热量,所以1mol硫单质完全燃烧可放出297kJ的热量,硫单质燃烧热的热化学方程式S(s)+O2(g)=SO2(g);△H=-297kJ•mol-1,
故答案为:S(s)+O2(g)=SO2(g);△H=-297kJ/mol;
②增大压强后,SO2的平衡转化率提高得并不多,加压对设备的要求高且耗能多,将增大投资和能量消耗.400℃~500℃作为操作温度,因为在这个温度范围内,催化剂的活性(反应速率)和SO2的平衡转化率都比较理想.故选择400℃~500℃,1MPa大气压.故答案为:B;
③由于反应SO3+H2O=H2SO4是一个放热反应,如果用水或稀硫酸吸收SO3,放出的热量会使溶液形成大量的酸雾,不利于SO3的吸收,所以工业上用98.3%的浓硫酸吸收SO3,然后在水或稀硫酸中稀释浓硫酸,制得各种浓度的硫酸产品.故答案为:C;
(2)①碳与浓硫酸反应生成二氧化碳、二氧化硫、水,反应方程式为C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ CO2↑+2SO2↑+2H2O,
故答案为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ CO2↑+2SO2↑+2H2O;
②11.2L(标准状况)SO2的物质的量0.5mol,催化剂作用下与CO发生化学反应,有2×6.02×1023个电子转移时,令硫元素在还原产物中的化合价为x,则0.5(4-x)=2,解得x=0,所以硫元素被还原为硫单质,反应方程式为SO2+2CO$\frac{\underline{催化剂}}{△}$ S+2CO2.故答案为:SO2+2CO$\frac{\underline{催化剂}}{△}$S+2CO2.
点评 以元素推断为载体,考查性质与物质关系、电子式、热化学反应方程式、氧化还原反应、化学工业制备硫酸等,难度中等,推断元素是关键,是对所学知识的综合运用与学生能力考查.注意基础知识的掌握与灵活运用.

| 元素 | A | B | C | D | E |
| 性质或结构信息 | 室温下单质呈气态,原子最外层电子数与D相同 | D3B中阳离子与阴离子的电子层结构相同 | A和C可形成两种常见的化合物甲和乙,乙具有弱酸性 | 单质质软、银白色固体、导电性强,在空气中燃烧生成淡黄色固体 | E是一种气态氧化物丙,丙相对于空气的密度为3.0,溶于水可得只含单一溶质的弱酸性溶液,该溶液在放置过程中其酸性会增强 |
(1)B在周期表中的位置是第二周期ⅤA族,B的氢化物与E的氢化物比较,沸点较高的是NH3(填化学式).
(2)写出D3B与甲反应所得溶液呈碱性(填“酸性”、“碱性”或“中性”),原因是(用离子方程式表示)N3-+4H2O?═?NH3•H2O+3OH-.
(3)写出丙的电子式为
 ;并说明丙的水溶液在放置过程中其酸性会增强的原因(用化学方程式表示)2HClO$\frac{\underline{\;\;△\;\;}}{\;}$2HCl+O2↑.
;并说明丙的水溶液在放置过程中其酸性会增强的原因(用化学方程式表示)2HClO$\frac{\underline{\;\;△\;\;}}{\;}$2HCl+O2↑.(4)由A、B、C、D四种元素中的三种元素组成的一种盐丁,其外观与氯化钠相似,丁的水溶液呈碱性.
I.可用鉴别丁和氯化钠的试剂有ABC.
A.氢碘酸和淀粉的混合液 B.AgNO3溶液 C.稀硫酸
Ⅱ.将光亮的铜丝插入丁溶液中,没有现象发生,如用盐酸酸化,反应迅速发生,铜丝缓慢溶解生成深蓝色溶液,写出该反应的离子方程式Cu+2NO2-+4H+═Cu2++2NO↑+2H2O.
Ⅲ.泡菜含有多种维生素和无机盐,但也含有丁.一般情况下,当人体一次性摄取300~500mg丁时,就会引起中毒.某学习小组用碘量法测定泡菜中丁的含量.已知:2Na2S2O3+I2═Na2S4O6+2NaI.取lkg泡菜)A、B、C、D、E为原子序数依次增大的五种短周期元素,其性质或结构信息如下表:
榨汁,将榨出的液体收集后,加入提取剂和氢氧化钠,使得到的泡菜汁中的有毒无机盐都转化为丁.在过滤后的滤液中加入氢氧化铝乳液,以除去色素.再次过滤后得到滤液,将该滤液稀释至lL,取25.00mL该滤液与过量的稀硫酸和碘化钾的混合溶液反应,再选用合适的指示剂,用Na2S2O3溶液进行滴定,共消耗0.050mol•L-1Na2S2O3溶液20.00mL.请回答下列问题:
①有经验的厨师在做泡菜时往往加入适量的橙汁,以减轻丁的危害.主要是因为橙汁中含有丰富的维生素C,这说明维生素C具有还原性.
②通过计算判断某人一次食入0.125kg这种泡菜是否会引起中毒,原因是由于345mg>300mg,会引起中毒.
 现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题.
现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题.| A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离能分别为 I1=738,I2=1451,I3=7733,I4=10540(单位:kJ/mol) |
| D原子核外所有p轨道全满或半满 |
| E元素的主族序数与周期数的差为4 |
| F是前四周期中电负性最小的元素 |
| G在周期表的第七列 |
(2)B基态原子中能量最高的电子,其电子云在空间有3个方向,原子轨道呈纺锤形形.
(3)某同学根据上述信息,推断C基态原子的核外电子排布为,
 该同学所画的电子排布图违背了泡利原理.
该同学所画的电子排布图违背了泡利原理.(4)G位于第ⅦB族d区,价电子排布式为3d54s2.
(5)DE3中心原子的杂化方式为sp3,用价层电子对互斥理论推测其空间构型为三角锥形.
(6)F元素的晶胞如图所示,若设该晶胞的密度为a g/cm3,阿伏加德罗常数为NA,F原子的摩尔质量为M g/mol,则F原子的半径为$\frac{\sqrt{3}}{4}$×$\root{3}{\frac{2M}{a{N}_{A}}}$ cm.
 锂锰电池的体积小、性能优良,是常用的一次电池.该电池反应原理如图所示,其中电解质LiClO4.溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2.下列有关说法正确的是( )
锂锰电池的体积小、性能优良,是常用的一次电池.该电池反应原理如图所示,其中电解质LiClO4.溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2.下列有关说法正确的是( )| A. | 外电路的电流方向是由a极流向b极 | |
| B. | 电池正极反应式为MnO2+e-+Li+=LiMnO2 | |
| C. | 可用水代替电池中的混合有机溶剂 | |
| D. | 每转移0.1mol电子,理论上消耗Li的质量为3.5g |
| A. | 25℃时,pH=13的1.0 L Ba(OH)2溶液中含有的OH-数目为0.2NA | |
| B. | 100 mL 1 mol•L-1的H2SO4溶液中含有0.1NA个H+ | |
| C. | 将4 g NaOH溶于100 g蒸馏水中,所得溶液物质的量浓度是0.1 mol•L-1 | |
| D. | 20g重水(D2O)所含的电子数为10NA |
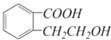 它可通过不同的反应分别得到下列物质:
它可通过不同的反应分别得到下列物质: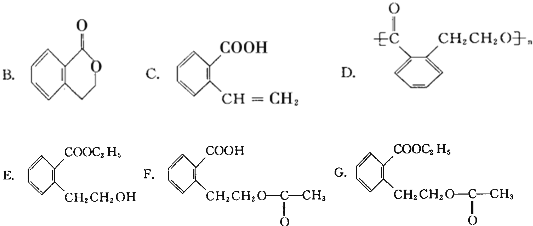
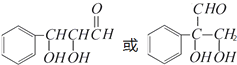 .(注:同一碳原子上连两个或两个以上羟基不稳定,故书写时排除此类化合物.)
.(注:同一碳原子上连两个或两个以上羟基不稳定,故书写时排除此类化合物.)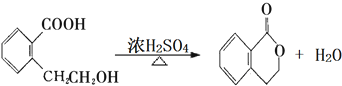 .
.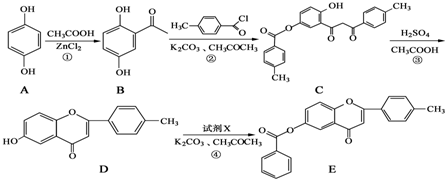
 +
+ $\stackrel{K_{2}CO_{3}、CH_{3}COCH_{3}}{→}$
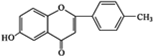
$\stackrel{K_{2}CO_{3}、CH_{3}COCH_{3}}{→}$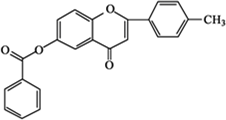 +HCl.
+HCl.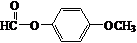 .
.