题目内容
12.Fe和Fe2O3 的混合物共13.6g,加入150mL稀H2SO4,在标准状况下收集到1.12LH2,Fe和Fe2O3 均无剩余.为中和过量的H2SO4,并使Fe元素全部转化为Fe(OH)2 沉淀,消耗了200mL 3mol/L的NaOH溶液,则该H2SO4 的物质的量浓度为( )| A. | 2.25mol/L | B. | 2mol/L | C. | 4mol/L | D. | 0.6mol/L |
分析 Fe和Fe2O3的混合物与稀H2SO4反应,Fe和Fe2O3均无剩余,且有H2生成,说明反应生成FeSO4,再加入NaOH溶液,使FeSO4全部转化为Fe(OH)2沉淀,反应后溶液成分为Na2SO4,根据硫酸根守恒有n(H2SO4)=n(Na2SO4),根据钠离子守恒有n(Na2SO4)=n(NaOH),进而计算硫酸的物质的量浓度.
解答 解:Fe和Fe2O3的混合物与稀H2SO4反应,Fe和Fe2O3均无剩余,且有H2生成,说明反应生成FeSO4,为了中和过量的硫酸,而且使FeSO4完全转化成Fe(OH)2,共消耗3mol/L的NaOH溶液200mL,说明反应后的溶液溶质只有Na2SO4,
根据硫酸根守恒,则n(H2SO4)=n(Na2SO4),根据钠离子守恒,则n(Na2SO4)=n(NaOH),
则有:n(H2SO4)=n(Na2SO4)=n(NaOH)=×3mol/L×0.2L=0.3mol,
故该硫酸的物质的量浓度为:c(H2SO4)==2mol/L,
故选B.
点评 本题考查混合物的有关计算,题目难度中等,明确发生的反应是解答关键,注意利用守恒方法进行的计算,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
 53天天练系列答案
53天天练系列答案
相关题目
2. 在微电子工业中NF3常用作氮化硅的蚀刻剂,工业上通过电解含NH4F等的无水熔融物生产NF3,其电解原理如图.下列说法不正确的是( )
在微电子工业中NF3常用作氮化硅的蚀刻剂,工业上通过电解含NH4F等的无水熔融物生产NF3,其电解原理如图.下列说法不正确的是( )
 在微电子工业中NF3常用作氮化硅的蚀刻剂,工业上通过电解含NH4F等的无水熔融物生产NF3,其电解原理如图.下列说法不正确的是( )
在微电子工业中NF3常用作氮化硅的蚀刻剂,工业上通过电解含NH4F等的无水熔融物生产NF3,其电解原理如图.下列说法不正确的是( )| A. | a电极为电解池的阳极 | |
| B. | 阳极的电极反应式:NH4++3F--6e-=NF3+4H+ | |
| C. | 电解过程中还会生成少量氧化性极强的气体单质,该气体的 分子式是F2 | |
| D. | H+由b极移向a极,并参与电极反应 |
3.已知氢气的燃烧热为286kJ/mol;且H2O(g)=H2O(l)△H=-44kJ/mol.下列热化学方程式正确的是( )
| A. | 2H2(g)+O2(g)=2H2O(g)△H=-286 kJ/mol | B. | 2H2(g)+O2(g)=2H2O(g)△H=-572 kJ/mol | ||
| C. | H2(g)+O2(g)=H2O(g)△H=-330 kJ/mol | D. | H2O(g)=H2(g)+O2(g)△H=+242 kJ/mol |
20.化学反应的实质是旧键的断裂和新键的生成,在探讨发生反应的分子中化学键在何处断裂的问题时,近代科技常用同位素示踪原子法.如有下列反应: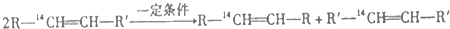
可以推知,化合物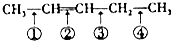 反应时断裂的化学键应是( )
反应时断裂的化学键应是( )
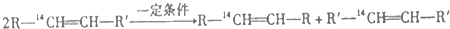
可以推知,化合物
 反应时断裂的化学键应是( )
反应时断裂的化学键应是( )| A. | ①③ | B. | ①④ | C. | ② | D. | ②③ |
7.下列有关溶液组成的描述合理的是( )
| A. | 弱碱性溶液中可能大量存在Na+、K+、Cl-、HCO3- | |
| B. | 酸性溶液中可能大量存在Na+、ClO-、SO42-、I- | |
| C. | 无色溶液中可能大量存在Al3+、NH4+、Cl-、OH- | |
| D. | 红色溶液中可能大量存在Fe3+、K+、Cl-、SCN- |
4.下列说法正确的是( )
| A. | 加热NH4C1晶体时,将湿润的红色石蕊试纸靠近试管口,检验NH3的生成 | |
| B. | 取少量溶液X,向其中加入适量新制氯水,再加几滴KSCN溶液,溶液变红,说明X溶液中一定含有Fe2+ | |
| C. | 除去KNO3中的少量NaCl,可将混合物制成热的饱和溶液,冷却结晶,过滤 | |
| D. | 通过灼热的镁粉除去N2中的O2 |
1.随着社会的发展,人们日益重视环境问题,下列说法不正确的是( )
| A. | 绿色化学的核心是利用化学原理从源头上减少和消除化学工业生产对环境的污染 | |
| B. | 对废旧电池进行回收处理主要是为了防止重金属污染水源和土壤 | |
| C. | 采用催化转换技术将汽车尾气中的NOx和CO转化为无毒气体 | |
| D. | PM2.5是指大气中直径接近于2.5×10-6m的细颗粒物,它们分散在空气中形成的混合物具有丁达尔效应 |
2.在25℃时,浓度均为0.2mol/L的NaHCO3和Na2CO3溶液中,下列判断正确的是( )
| A. | c(OH-)前者大于后者 | |
| B. | 与同浓度的盐酸反应时的反应速率前者大于后者 | |
| C. | 分别加入1L的0.2 mol/L的HNO3 后一定产生4.48LCO2 | |
| D. | 溶液中阳离子浓度相同 |
