题目内容
7.下列有关溶液组成的描述合理的是( )| A. | 弱碱性溶液中可能大量存在Na+、K+、Cl-、HCO3- | |
| B. | 酸性溶液中可能大量存在Na+、ClO-、SO42-、I- | |
| C. | 无色溶液中可能大量存在Al3+、NH4+、Cl-、OH- | |
| D. | 红色溶液中可能大量存在Fe3+、K+、Cl-、SCN- |
分析 离子之间能反应生成气体、沉淀、弱电解质或发生氧化还原反应、复分解反应的不能大量共存,据此分析解答.
解答 解:A.弱碱性条件下,这几种离子之间不反应,能大量共存,故A正确;
B.酸性条件下,ClO-、I-发生氧化还原反应而不能大量共存,故B错误;
C.Al3+、NH4+、Cl-、OH-都无色,但Al3+、NH4+、OH-之间能反应,所以不能大量共存,故C错误;
D.Fe3+、SCN-反应生成络合物而不能大量共存,故D错误;
故选A.
点评 本题考查离子共存,为高频考点,侧重考查复分解反应、氧化还原反应,明确离子共存条件及离子性质是解本题关键,易错选项是B.

练习册系列答案
 计算高手系列答案
计算高手系列答案
相关题目
17.下表是元素周期表的一部分,请用元素符号或化学式回答有关问题:
(1)表中化学性质最不活泼的元素是Ar,最活泼的金属元素是K,最活泼的非金属元素是F.
(2)表中能形成两性氧化物的元素是Al,写出该元素的单质与⑨最高价氧化物的水化物反应的离子方程式2Al+2OH-+2H2O═2AlO2-+3H2↑.
(3)③⑥⑦三种元素原子半径由大到小的顺序是S>Cl>F.
(4)用电子式表示由元素⑨⑦形成化合物的过程:K++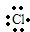 →
→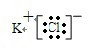 .
.
(5)③元素与⑩元素两者核电荷数之差是26.
(6)设计实验方案:比较⑦与⑩单质氧化性的强弱,请将方案填入下表.
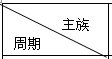 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
(2)表中能形成两性氧化物的元素是Al,写出该元素的单质与⑨最高价氧化物的水化物反应的离子方程式2Al+2OH-+2H2O═2AlO2-+3H2↑.
(3)③⑥⑦三种元素原子半径由大到小的顺序是S>Cl>F.
(4)用电子式表示由元素⑨⑦形成化合物的过程:K++
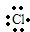 →
→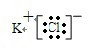 .
.(5)③元素与⑩元素两者核电荷数之差是26.
(6)设计实验方案:比较⑦与⑩单质氧化性的强弱,请将方案填入下表.
| 实验步骤 | 实验现象与结论 |
18.下列有关说法不正确的是( )
| A. | 在氨水中加入少量的水或氯化铵固体后,都能使溶液中的c(NH4+)减小 | |
| B. | 相同体积、pH均为3的HA和HB两种酸分别与足量的锌充分反应,HA放出的氢气多,说明HB的酸性比HA的酸性强 | |
| C. | 工业电解食盐水中,电解池被阳离子交换膜隔成阴极室和阳极室,目的是避免阳极产生的气体与烧碱反应 | |
| D. | 在等浓度的NaCl和Na2CrO4稀溶液中滴加AgNO3溶液,先析出AgCl沉淀,则Ksp(AgCl)<Ksp(Ag2CrO4) |
15.如图所示装置能够组成原电池,并且能产生明显电流的是( )
| A. | 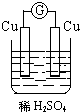 | B. | 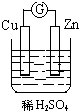 | C. | 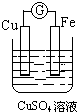 | D. | 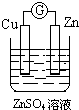 |
12.Fe和Fe2O3 的混合物共13.6g,加入150mL稀H2SO4,在标准状况下收集到1.12LH2,Fe和Fe2O3 均无剩余.为中和过量的H2SO4,并使Fe元素全部转化为Fe(OH)2 沉淀,消耗了200mL 3mol/L的NaOH溶液,则该H2SO4 的物质的量浓度为( )
| A. | 2.25mol/L | B. | 2mol/L | C. | 4mol/L | D. | 0.6mol/L |
19.萜品醇可作为消毒剂、抗氧化剂和溶剂.已知α-萜品醇的结构简式如下式,则下列说法错误的是( )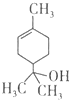

| A. | 1mol该物质最多能和lmol氢气发生加成反应 | |
| B. | 该物质属于烃 | |
| C. | 该物质能使溴水褪色 | |
| D. | 分子式为C9H16O |
16.锌粉、铝粉的混合物44g与一定量浓度为17.25%的硫酸溶液恰好反应,将溶液蒸发结晶得干燥的无水固体140g,则放出的气体在标准状况下的体积为( )
| A. | 无法计算 | B. | 6.72L | C. | 33.6L | D. | 22.4L |
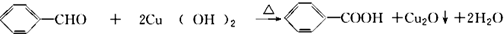 .
.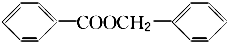 .
.