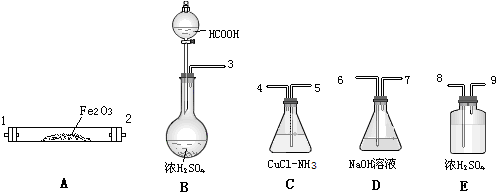
题目内容
2.在25℃时,浓度均为0.2mol/L的NaHCO3和Na2CO3溶液中,下列判断正确的是( )| A. | c(OH-)前者大于后者 | |
| B. | 与同浓度的盐酸反应时的反应速率前者大于后者 | |
| C. | 分别加入1L的0.2 mol/L的HNO3 后一定产生4.48LCO2 | |
| D. | 溶液中阳离子浓度相同 |
分析 A、CO32-的水解程度远远大于HCO3-水解程度;水解规律:谁强显谁性;
B、碳酸氢钠可以和盐酸直接反应得到二氧化碳气体,但是碳酸钠和盐酸反应先是转化为碳酸氢根离子,然后放出二氧化碳;
C、分别加入1L的0.2 mol/L的HNO3后,碳酸氢钠可以和酸直接反应得到二氧化碳气体,但是碳酸钠和酸反应先是转化为碳酸氢根离子,然后放出二氧化碳,据此计算;
D、碳酸根离子的水解程度大于碳酸氢根离子的水解程度,据此回答.
解答 解:A、CO32-的水解程度远远大于HCO3-水解程度,二者水解均显碱性,根据水解规律:谁强显谁性,所以Na2CO3中的氢氧根浓度大于NaHCO3溶液中的氢氧根浓度,故A错误;
B、碳酸氢钠可以和盐酸直接反应得到二氧化碳气体,但是碳酸钠和盐酸反应先是转化为碳酸氢根离子,然后放出二氧化碳,所以浓度均为0.2mol/L的NaHCO3和Na2CO3溶液与同浓度的盐酸反应时的反应速率前者大于后者,故B正确;
C、浓度均为0.2mol/L的NaHCO3和Na2CO3溶液,分别加入1L的0.2 mol/L的HNO3后,产生二氧化碳的量取决于碳酸钠、碳酸氢钠的浓度以及体积的大小,故C错误;
D、碳酸根离子的水解程度大于碳酸氢根离子的水解程度,所以碳酸钠中氢离子浓度小于碳酸氢钠中氢离子浓度,二者的溶液中钠离子浓度是一样的,所以溶液中阳离子浓度是碳酸氢钠溶液中更大,故D错误.
故选B.
点评 本题考查盐的水解的应用,明确水解原理及盐类水解规律的应用是解题的关键,难度不大.

练习册系列答案
相关题目
12.Fe和Fe2O3 的混合物共13.6g,加入150mL稀H2SO4,在标准状况下收集到1.12LH2,Fe和Fe2O3 均无剩余.为中和过量的H2SO4,并使Fe元素全部转化为Fe(OH)2 沉淀,消耗了200mL 3mol/L的NaOH溶液,则该H2SO4 的物质的量浓度为( )
| A. | 2.25mol/L | B. | 2mol/L | C. | 4mol/L | D. | 0.6mol/L |
13.对于等物质的量浓度的Na2CO3和NaHCO3溶液,下列说法错误的是( )
| A. | 相同温度下两种溶液的pH:Na2CO3>NaHCO3 | |
| B. | 若分别升高温度,两种溶液的pH均减小 | |
| C. | 若分别加入少量NaOH,两溶液中c(CO32-)均增大 | |
| D. | 两溶液中的离子浓度均存在关系:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-) |
10.下列有关物质的性质和该性质的应用均正确的是( )
| A. | 二氧化硅不与任何酸反应,可用石英制造耐酸容器 | |
| B. | 二氧化氯具有还原性,可用于自来水的杀菌消毒 | |
| C. | 常温下浓硫酸使铝钝化,可在常温下用铝制贮罐贮运浓硫酸 | |
| D. | 二氧化氮溶于水时只生成唯一产物硝酸,工业上利用这一原理生产硝酸 |
14.下列实验事实与图象对应正确的是( )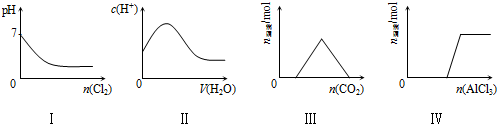

| A. | I表示向Na2SO3溶液中通入Cl2 | |
| B. | II表示向纯CH3COOH中逐滴加水并不断振荡 | |
| C. | III表示向KOH和Ca(OH)2混合液中通入CO2 | |
| D. | Ⅳ表示向NaOH溶液中逐滴加入AlCl3溶液并不断振荡 |
11.从碘的有机溶液中回收有机溶剂,可选用的实验装置是( )
| A. | 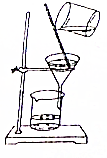 | B. | 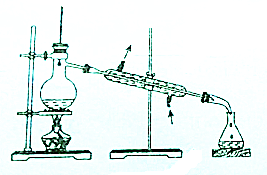 | ||
| C. | 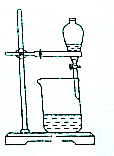 | D. | 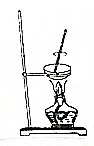 |