题目内容
3.已知氢气的燃烧热为286kJ/mol;且H2O(g)=H2O(l)△H=-44kJ/mol.下列热化学方程式正确的是( )| A. | 2H2(g)+O2(g)=2H2O(g)△H=-286 kJ/mol | B. | 2H2(g)+O2(g)=2H2O(g)△H=-572 kJ/mol | ||
| C. | H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-330 kJ/mol | D. | H2O(g)=H2(g)+$\frac{1}{2}$O2(g)△H=+242 kJ/mol |
分析 根据氢气的燃烧热为286kJ/mol写出氢气的燃烧热的热化学方程式:H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-286 kJ/mol ①
又已知:H2O(g)=H2O(l)△H=-44kJ/mol ②
将①②做相应的变形,结合盖斯定律来解答.
解答 解:根据氢气的燃烧热为286kJ/mol,即1mol氢气完全燃烧生成稳定的氧化物时所放出的热量,此时生成的水一定为液态水,故氢气的燃烧热的热化学方程式:H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-286 kJ/mol ①
又已知:H2O(g)=H2O(l)△H=-44kJ/mol ②
将①×2-②×2可得:2H2(g)+O2(g)=2H2O(g)△H=-484kJ/mol ③,故AB错误;
将$\frac{③}{2}$可得:H2O(g)=H2(g)+$\frac{1}{2}$O2(g)△H=+242 kJ/mol,故C错误,D正确.
故选D.
点评 本题考查了燃烧热的概念和盖斯定律的运用,注意燃烧热是1mol可燃物燃烧和生成稳定化合物,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
7.可能造成光化学烟雾污染的气体是( )
| A. | SO2 | B. | NO2 | C. | CO2 | D. | CO |
18.下列有关说法不正确的是( )
| A. | 在氨水中加入少量的水或氯化铵固体后,都能使溶液中的c(NH4+)减小 | |
| B. | 相同体积、pH均为3的HA和HB两种酸分别与足量的锌充分反应,HA放出的氢气多,说明HB的酸性比HA的酸性强 | |
| C. | 工业电解食盐水中,电解池被阳离子交换膜隔成阴极室和阳极室,目的是避免阳极产生的气体与烧碱反应 | |
| D. | 在等浓度的NaCl和Na2CrO4稀溶液中滴加AgNO3溶液,先析出AgCl沉淀,则Ksp(AgCl)<Ksp(Ag2CrO4) |
8.下列指定反应的离子方程式正确的是( )
| A. | 用铜作电极电解Na2SO4溶液:Cu+2H+$\frac{\underline{\;通电\;}}{\;}$Cu2++H2↑ | |
| B. | NH4Al(SO4)2溶液与过量稀氨水反应:Al3++3NH3•H2O=Al(OH)3↓+3NH4+ | |
| C. | 用稀硝酸清洗试管内壁的银镜:Ag+2H++NO3-=Ag++NO2↑+H2O | |
| D. | 过量氯气通入碘化亚铁溶液中:2Cl2+2Fe3++2I=4Cl-+2Fe3++I2 |
15.如图所示装置能够组成原电池,并且能产生明显电流的是( )
| A. | 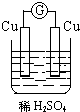 | B. | 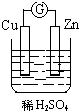 | C. | 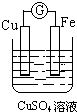 | D. | 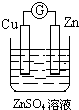 |
12.Fe和Fe2O3 的混合物共13.6g,加入150mL稀H2SO4,在标准状况下收集到1.12LH2,Fe和Fe2O3 均无剩余.为中和过量的H2SO4,并使Fe元素全部转化为Fe(OH)2 沉淀,消耗了200mL 3mol/L的NaOH溶液,则该H2SO4 的物质的量浓度为( )
| A. | 2.25mol/L | B. | 2mol/L | C. | 4mol/L | D. | 0.6mol/L |
13.对于等物质的量浓度的Na2CO3和NaHCO3溶液,下列说法错误的是( )
| A. | 相同温度下两种溶液的pH:Na2CO3>NaHCO3 | |
| B. | 若分别升高温度,两种溶液的pH均减小 | |
| C. | 若分别加入少量NaOH,两溶液中c(CO32-)均增大 | |
| D. | 两溶液中的离子浓度均存在关系:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-) |
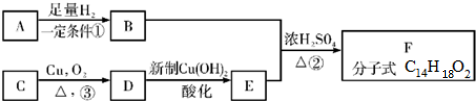
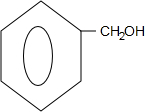 .
.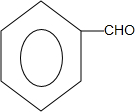 +2H2O;
+2H2O;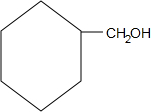 +
+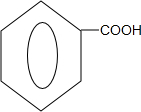 $?_{△}^{浓硫酸}$
$?_{△}^{浓硫酸}$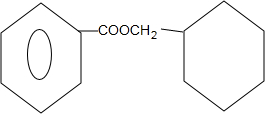 +H2O.
+H2O.