题目内容
11.锂因其重要的用途,被誉为“能源金属”和“推动世界前进的金属”.(1)Li3N可由Li在N2中燃烧制得.取4.164g 锂在N2中燃烧,理论上生成Li3N6.964g;因部分金属Li没有反应,实际反应后固体质量变为6.840g,则固体中Li3N的质量是6.656g(保留三位小数,Li3N的式量:34.82)
(2)已知:Li3N+3H2O→3LiOH+NH3↑.取17.41g纯净Li3N,加入100g水,充分搅拌,完全反应后,冷却到20℃,产生的NH3折算成标准状况下的体积是11.2L.过滤沉淀、洗涤、晾干,得到LiOH固体26.56g,计算20℃时LiOH的溶解度12.8g.(保留1位小数,LiOH的式量:23.94.写出计算过程)
锂离子电池中常用的LiCoO2,工业上可由碳酸锂与碱式碳酸钴制备.
(3)将含0.5molCoCl2的溶液与含0.5molNa2CO3的溶液混合,充分反应后得到碱式碳酸钴沉淀53.50g;过滤,向滤液中加入足量HNO3酸化的AgNO3溶液,得到白色沉淀143.50g,经测定溶液中的阳离子只有Na+,且Na+有1mol;反应中产生的气体被足量NaOH溶液完全吸收,使NaOH溶液增重13.20g,通过计算确定该碱式碳酸钴的化学式,写出制备碱式碳酸钴反应的化学方程式.
(4)Co2(OH)2CO3和Li2CO3在空气中保持温度为600~800℃,可制得LiCoO2,已知:
3Co2(OH)2CO3+O2→2Co3O4+3H2O+3CO2;4Co3O4+6Li2CO3+O2→12LiCoO2+6CO2
按钴和锂的原子比1:1混合固体,空气过量70%,800℃时充分反应,计算产物气体中CO2的体积分数.(保留三位小数,已知空气组成:N2体积分数0.79,O2体积分数0.21)
分析 (1)根据方程式6Li+N2$\frac{\underline{\;点燃\;}}{\;}$2Li3N计算;设反应后Li的质量为xg,Li3N的质量为yg,根据已知数据列方程组计算;
(2)根据n(Li3N)=$\frac{m}{M}$计算,再根据N元素守恒计算氨气的物质的量和体积;根据方程式计算出生成的LiOH的质量,由得到LiOH固体26.56g,可求出溶液中LiOH的质量,再求出溶解度;
(3)含0.5molCoCl2的溶液与含0.5molNa2CO3的溶液混合,生成气体为氢氧化钠吸收是二氧化碳,根据碳元素守恒,可知碱式碳酸钴中的碳酸根离子为0.2mol,根据氯化银的质量判断氯离子全部在溶液中,再根据电荷守恒计算氢氧根离子的物质的量,再由碱式碳酸钴沉淀53.50g、钴元素的质量、碳酸根离子的质量和氢氧根离子的质量求出结晶水的质量和物质的量,然后求出碱式碳酸钴的化学式;
(4)由3Co2(OH)2CO3+O2→2Co3O4+3H2O+3CO2;4Co3O4+6Li2CO3+O2→12LiCoO2+6CO2
可得方程式:6Co2(OH)2CO3+6Li2CO3+3O2$\frac{\underline{\;600~800℃\;}}{\;}$12LiCoO2+6H2O+12CO2;
令参加反应的氧气为3mol,则相当于$\frac{3}{0.21}$mol空气,空气过量70%,则空气通入(1+0.7)×$\frac{3}{0.21}$mol,生成6mol水(g)和12mol CO2,据此计算CO2的体积分数.
解答 解:(1)设生成的Li3N为xg,
6Li+N2$\frac{\underline{\;点燃\;}}{\;}$2Li3N
6×6.94 2×34.82
4.164g mg
则m=$\frac{2×34.82×4.164g}{6×6.94}$=6.964g;
设反应后Li的质量为xg,Li3N的质量为yg,
则xg+yg=6.840g,xg+yg×$\frac{3×6.94}{34.82}$=4.164g;
解得:x=0.184,y=6.656;
故答案为:6.964;6.656;
(2)已知:Li3N+3H2O→3LiOH+NH3↑,17.41gLi3N的物质的量为n=$\frac{m}{M}$=$\frac{17.41g}{34.82g/mol}$=0.5mol,
由氮元素守恒可知,n(NH3)=0.5mol,则氨气的体积V=nVm=11.2L;
由Li元素守恒可知n(LiOH)=0.5mol×3=1.5mol,则m(LiOH)=nM=1.5mol×23.94g/mol=35.91g,
m(水)=100-1.5mol×18g/mol=73g,
则$\frac{s}{100}$=$\frac{35.91-26.56}{73}$,解得s=12.8g;
故答案为:11.2;12.8g;
(3)反应中产生的气体被足量NaOH溶液完全吸收,使NaOH溶液增重13.20g,则由元素守恒可知该物质为是二氧化碳,其物质的量为$\frac{13.20g}{44g/mol}$=0.3mol,由碳元素守恒可知,碱式碳酸钴中的碳酸根离子为0.2mol;加入足量HNO3酸化的AgNO3溶液,得到白色沉淀143.50g,则143.50g是氯化银沉淀,其物质的量为1mol,则氯离子为1mol,又根据钠离子为1mol,则碱式碳酸钴中不含钠元素和氯元素,所以碱式碳酸钴中有钴0.5mol,碳酸根离子为0.2mol,根据电荷守恒,应含氢氧根离子为0.6mol,
碱式碳酸钴中结晶水的质量为:53.50g-0.5mol×58.93g/mol-0.2mol×60g/mol-0.6mol×17g/mol=1.8g,则n(水)=0.1mol,
所以碱式碳酸钴中:钴离子0.5mol,碳酸根离子为0.2mol,氢氧根离子为0.6mol,结晶水0.1mol,
则碱式碳酸钴的化学式:2CoCO3•3Co(OH)2•H2O;
则制备碱式碳酸钴反应的化学方程式:5CoCl2+5Na2CO3+4H2O=2CoCO3•3Co(OH)2•H2O+10NaCl+3CO2↑;
答:碱式碳酸钴的化学式2CoCO3•3Co(OH)2•H2O;制备碱式碳酸钴反应的化学方程式为:5CoCl2+5Na2CO3+4H2O=2CoCO3•3Co(OH)2•H2O+10NaCl+3CO2↑;
(4)由3Co2(OH)2CO3+O2→2Co3O4+3H2O+3CO2;4Co3O4+6Li2CO3+O2→12LiCoO2+6CO2
可得方程式:6Co2(OH)2CO3+6Li2CO3+3O2$\frac{\underline{\;600~800℃\;}}{\;}$12LiCoO2+6H2O+12CO2;
令参加反应的氧气为3mol,则相当于$\frac{3}{0.21}$mol空气,空气过量70%,则空气通入(1+0.7)×$\frac{3}{0.21}$mol,生成6mol水(g)和12mol CO2;
所以产物气体中CO2的体积分数=$\frac{12mol}{(12+6-3+1.7×\frac{3}{0.21})mol}$=0.305;
答:产物气体中CO2的体积分数为0.305.
点评 本题考查了有关化学方程式的计算,题目难度较大,侧重于考查学生的分析能力和计算能力.

 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案| 元素 | A | B | C | D |
| 性质或结构信息 | 工业上通过分离液态空气获得其单质,单质能助燃 | 气态氢化物显碱性 | +3价阳离子的核外电子排布与氖原子相同 | 第三周期原子半径最小 |
(2)C的原子结构示意图为
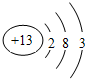 ,C单质与NaOH溶液反应的离子方程式为2Al+2H2O+2OH-=2AlO2-+3H2↑.
,C单质与NaOH溶液反应的离子方程式为2Al+2H2O+2OH-=2AlO2-+3H2↑.(3)D的单质与A的一种氢化物反应生成具有漂白性的物质,反应的化学方程式为:Cl2+H2O=HCl+HClO.
(4)D的最高价氧化物对应的水化物的分子式为HClO4,其酸性比H2SO4强(填“强”或“弱”).
| A. | B4C是一种分子晶体 | B. | B4C是该物质的分子式 | ||
| C. | B4C是一种原子晶体 | D. | 电子式为: |
| A. | 4个 | B. | 3个 | C. | 2个 | D. | 1个 |
| A. | 残留固体是2mol Na2CO3 | |
| B. | 残留固体是 Na2CO3和NaOH的混合物 | |
| C. | 反应中转移2mol电子 | |
| D. | 排出的气体是1.5mol氧气 |
| A. | 该实验表明SO2有漂白性 | B. | 白色沉淀为BaSO3 | ||
| C. | 该实验表明FeCl3有还原性 | D. | 反应后溶液酸性增强 |
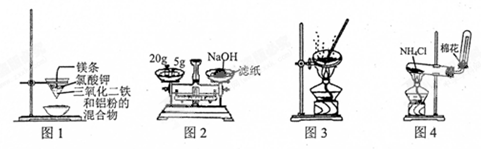
| A. | 用图1装置制取金属铁 | |
| B. | 用图2装置称量NaOH固体 | |
| C. | 用图3装置蒸干CuCl2饱和溶液制备CuCl2晶体 | |
| D. | 用图4装置制取氨气 |
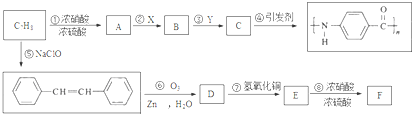
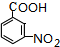 .A~E中互为同分异构体的还有
.A~E中互为同分异构体的还有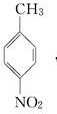 和
和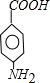 .(填结构简式)
.(填结构简式)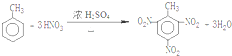 .
.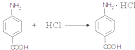 .
.