题目内容
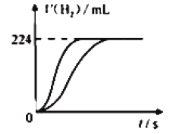
【题目】量取8.0mL 5.0 molL-1 H2SO4溶液,加蒸馏水稀释至100mL,取两份稀释后的H2SO4溶液各25mL,分别加入等质量的Zn和Fe,相同条件下充分反应,产生氢气的体积随时间变化的曲线如图所示(氢气体积已折算成标准状况下的体积)。下列说法正确的是
A.稀释后H2SO4溶液的物质的量浓度为0.04 molL-1
B.加入Fe的质量至少有0.56 g
C.反应过程中铁粉过量
D.金属Zn与硫酸反应转移电子数为0.01NA
【答案】C
【解析】
根据题给条件和图可知,产生的H2相等,必有:消耗的硫酸相等,消耗的Zn和Fe物质的量相等。由于等质量Fe比Zn物质的量多,所以Fe必有剩余,则与Fe反应的硫酸消耗完;两个反应消耗的硫酸相等,所以与Zn反应的硫酸也消耗完;而Zn可能反应完,也可能没有反应完。可在此基础上并对各选项作出判断。
A. 稀释后H2SO4溶液的物质的量浓度为5.0 molL-1×8.0÷100=0.4 molL-1,A选项错误;
B. 产生的H2物质的量为224×10-3L÷(22.4 Lmol-1)=0.01mol,根据分析,Fe有剩余,所以Fe的质量大于0.01mol×56 gmol-1=0.56 g,不能等于0.56 g,B选项错误;
C. 产生的H2相等,则消耗的Zn和Fe物质的量相等,等质量Fe比Zn物质的量多,所以Fe必有剩余,C选项正确;
D. 金属Zn与硫酸反应转移电子数为0.01mol×2×NA mol-1=0.02NA,D选项错误;
答案选C。

练习册系列答案
 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案 新思维寒假作业系列答案
新思维寒假作业系列答案
相关题目