题目内容
【题目】2019年诺贝尔化学奖授予约翰·古迪纳夫、斯坦利·威廷汉和吉野彰,表彰他们对锂离子电池研究的贡献。磷酸亚铁锂(LiFePO4)电池是新能源汽车的动力电池之一。采用湿法冶金工艺回收废旧磷酸亚铁锂电池正极片(除LiFePO4外,还含有Al箔、少量不溶于酸碱的导电剂)中的资源,部分流程如图:

(1)从“正极”可以回收的金属有___________________。
(2)“碱溶”时Al箔溶解的离子方程式_________________________。
(3)“酸浸”时产生标准状况下2.24L NO时,则被氧化的LiFePO4为_________mol。(其他杂质不与HNO3反应)
(4)实验测得滤液②中c(Li+)=4 mol·L-1,加入等体积的Na2CO3溶液后,Li+的沉降率到99%,则滤液③中c(CO![]() )=________mol·L-1。 [Ksp(Li2CO3)=1.6×10-3]
)=________mol·L-1。 [Ksp(Li2CO3)=1.6×10-3]
(5)磷酸亚铁锂电池总反应为:LiFePO4+6C ![]() Li1-xFePO4+LixC6,电池中的固体电解质可传导Li+。放电时,正极反应式为________________________。
Li1-xFePO4+LixC6,电池中的固体电解质可传导Li+。放电时,正极反应式为________________________。
(6)磷酸亚铁锂电池中铁的含量可通过如下方法测定:称取1.40g试样用盐酸溶解,在溶液中加入稍过量的SnCl2溶液,再加入HgCl2饱和溶液,用二苯胺磺酸钠作指示剂,用0.030 mol·L-1重铬酸钾溶液滴定至溶液由浅绿色变为蓝紫色,消耗重铬酸钾溶液40.00mL。
已知:2Fe3++Sn2++6Cl-= SnCl![]() +2Fe2+
+2Fe2+
4Cl-+Sn2++2HgCl2= SnCl![]() +Hg2Cl2
+Hg2Cl2
6Fe2++Cr2O![]() +14H+ = 6Fe3++2Cr3++7H2O
+14H+ = 6Fe3++2Cr3++7H2O
①实验中加入HgCl2饱和溶液的目的是________________________。
②磷酸亚铁锂电池中铁的含量为_______________。
【答案】Li、Fe、Al ![]() 0.3mol 4
0.3mol 4 ![]() 将溶液中过量的Sn2+转化为稳定的络合物SnCl
将溶液中过量的Sn2+转化为稳定的络合物SnCl![]() ,防止Fe2+的干扰 28.8%
,防止Fe2+的干扰 28.8%
【解析】
(1)根据元素守恒,即根据正极片中含有金属元素,其余导电剂中所含元素不明,均能通过一定方法进行回收再利用。
(2)“碱溶”时是Al箔与NaOH溶液反应,该离子方程式要求识记。
(3)“酸浸”时是硝酸将LiFePO4被氧化为FePO4,根据得失电子总数相等,即可进行求解。
(4)本题根据难溶电解质的溶度积进行计算即可,特别提醒是溶液中c(Li+)从4 mol·L-1因加入了等体积的Na2CO3溶液后变为2mol·L-1。
(5)放电时正极发生还原反应,结合题干中总反应分析不难得出正极反应式。
(6)根据题干的三个反应式可以得出Sn2+的还原性比Fe2+的强,HgCl2饱和溶液将Sn2+转化为更稳定的络离子SnCl![]() , 由反应6Fe2++Cr2O
, 由反应6Fe2++Cr2O![]() +14H+ = 6Fe3++2Cr3++7H2O即可进行铁元素质量分数的求算。
+14H+ = 6Fe3++2Cr3++7H2O即可进行铁元素质量分数的求算。
(1)根据元素守恒,正极片中含有Li、Fe、Al三种金属元素,均能通过一定方法进行回收再利用,故答案为:Li、Fe、Al;
(2)“碱溶”时Al箔与NaOH溶液反应的离子方程式为![]() ,故答案为:
,故答案为:![]() ;
;
(3)“酸浸”时是硝酸被还原产生NO,LiFePO4被氧化为FePO4,根据得失电子总数相等可知:![]() ,故答案为:0.3mol;
,故答案为:0.3mol;
(4)实验测得滤液②中c(Li+)=4 mol·L-1,加入等体积的Na2CO3溶液后,则溶液中的c(Li+)=2mol·L-1,Li+的沉降率到99%,溶液中剩余的c(Li+)=2mol·L-1![]() 1%=0.02mol/L,则滤液③中
1%=0.02mol/L,则滤液③中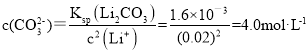 ,故答案为:4.0;
,故答案为:4.0;
(5)放电时正极发生还原反应,分析总反应:LiFePO4+6C ![]() Li1-xFePO4+LixC6,可以得出正极反应式为
Li1-xFePO4+LixC6,可以得出正极反应式为![]() ,故答案为:
,故答案为:![]() ;
;
(6)①有反应:2Fe3++Sn2++6Cl-= SnCl![]() +2Fe2+,可知Sn2+的还原性比Fe2+的强,当有Sn2+存在时,Cr2O
+2Fe2+,可知Sn2+的还原性比Fe2+的强,当有Sn2+存在时,Cr2O![]() 首先氧化Sn2+,故必须将Sn2+转化为更稳定的络离子SnCl
首先氧化Sn2+,故必须将Sn2+转化为更稳定的络离子SnCl![]() ,否则影响Fe2+的测量,故实验中加入HgCl2饱和溶液的目的是将溶液中过量的Sn2+转化为稳定的络合物SnCl
,否则影响Fe2+的测量,故实验中加入HgCl2饱和溶液的目的是将溶液中过量的Sn2+转化为稳定的络合物SnCl![]() ,防止Fe2+的干扰,故答案为:将溶液中过量的Sn2+转化为稳定的络合物SnCl
,防止Fe2+的干扰,故答案为:将溶液中过量的Sn2+转化为稳定的络合物SnCl![]() ,防止Fe2+的干扰;
,防止Fe2+的干扰;
②由反应6Fe2++Cr2O![]() +14H+ = 6Fe3++2Cr3++7H2O可知,
+14H+ = 6Fe3++2Cr3++7H2O可知,![]() ,故磷酸亚铁锂电池中铁的含量为
,故磷酸亚铁锂电池中铁的含量为![]() ,故答案为:28.8%。
,故答案为:28.8%。

【题目】某研究小组在电压为24V时进行如下实验,电解3分钟后,发现下列现象。
编号 | ① | ② | ③ |
装置 |
|
|
|
现象 | 小灯泡微弱发光,两极均产生气泡,阳极附近出现白色浑浊,阴极附近无明显变化 | 两极均产生气泡,溶液无明显变化 | 两极均产生气泡,阳极附近出现白色浑浊,阴极附近无明显变化 |
下列说法正确的是( )
A.①中小灯泡微亮是因为Ca(OH)2是弱电解质
B.对比①和②,白色浑浊的出现与电极材料无关
C.对比①和③,白色浑浊是由于OH-迁移到阳极使Ca(OH)2沉淀析出
D.阳极附近白色沉淀的成分可能是CaCO3