题目内容
【题目】将一定量的二氧化硫和含0.7 mol氧气的空气(忽略CO2)放入一定体积的密闭容器中,550℃时,在催化剂作用下发生反应2SO2+O2![]() 2SO3。反应达到平衡后,将容器中的混合气体通过过量氢氧化钠溶液,气体体积减小了21.28 L;再将剩余气体通过一种碱性溶液吸收氧气,气体的体积又减少了5.6 L(以上气体体积均为标准状况下的体积)。(计算结果保留一位小数)请回答下列问题:
2SO3。反应达到平衡后,将容器中的混合气体通过过量氢氧化钠溶液,气体体积减小了21.28 L;再将剩余气体通过一种碱性溶液吸收氧气,气体的体积又减少了5.6 L(以上气体体积均为标准状况下的体积)。(计算结果保留一位小数)请回答下列问题:
(1)判断该反应达到平衡状态的标志是(填字母)__________________。
a.二氧化硫和三氧化硫浓度相等
b.三氧化硫百分含量保持不变
c.容器中气体的压强不变
d.三氧化硫的生成速率与二氧化硫的消耗速率相等
e.容器中混合气体的密度保持不变
(2)求该反应达到平衡时,消耗二氧化硫的物质的量占原二氧化硫的物质的量的百分比____。
(3)若将平衡混合气体的5%通入过量的氯化钡溶液中,生成沉淀的质量是多少?______
【答案】 bc 94.7% 10.5 g
【解析】(1)可逆反应到达平衡时,同种物质的正逆速率相等,各组分的浓度、含量保持不变,由此衍生的其它一些量不变,判断平衡的物理量应随反应进行发生变化,该物理量由变化到不变化说明到达平衡;
(2)混合气体通过过量NaOH溶液时,减少的气体是二氧化硫和三氧化硫,剩余气体为氧气,利用硫元素守恒计算二氧化硫起始物质的量,根据剩余氧气的量计算参加反应的氧气的量,再根据方程式计算参加反应二氧化硫物质的量,进而计算消耗二氧化硫的物质的量占原二氧化硫的物质的量的百分比;
(3)三氧化硫物质的量等于参加反应的二氧化硫物质的量,三氧化硫反应生成硫酸钡,由S元素守恒计算硫酸钡质量。
(1)a.可逆反应到达平衡时SO2和SO3浓度不一定相等,与二氧化硫的转化率有关,a错误;b.可逆反应达到平衡状态时,各物质的百分含量不变,三氧化硫百分含量保持不变,说明到达平衡状态,b正确;c.随反应进行气体的物质的量减小,恒温恒容下,容器内气体压强减小,当容器中气体的压强不变,说明到达平衡状态,c正确;d.SO3的生成速率与SO2的消耗速率都表示正反应速率,始终二者都按1:1进行反应,不能说明到达平衡状态,d错误;e.混合气体的质量不变,容器的体积不变,所以密度始终不变,不能说明到达平衡状态,e错误;答案选bc;
(2)混合气体通过过量NaOH溶液时,减少的气体是二氧化硫和三氧化硫,所以三氧化硫和未参加反应的二氧化硫的体积是21.28L,剩余氧气的体积是5.6L,平衡时二氧化硫、三氧化硫总物质的量为21.28L÷22.4L/mol=0.95mol,根据S元素守恒可知,二氧化硫起始物质的量为0.95mol,平衡时氧气物质的量为5.6L÷22.4L/mol=0.25mol,则参加反应的氧气为0.7mol-0.25mol=0.45mol,由方程式可知参加反应的二氧化硫为0.45mol×2=0.9mol,故消耗二氧化硫的物质的量占原二氧化硫的物质的量的百分比为0.9mol/0.95mol×100%=94.7%;
(3)若将平衡混合气体的5%通入过量的BaCl2溶液,三氧化硫反应生成硫酸钡,由S元素守恒生成硫酸钡质量为0.9mol×5%×233g/mol=10.485g≈10.5g。

【题目】研究金属钠的性质,实验如下:
实验装置 | 实验方案 | |
液体a | 现象 | |
| 蒸馏水 | I.钠浮在水面,剧烈反应,有少量白雾 |
0.1 mol·L-1盐酸 | II.钠浮在液面,反应比Ⅰ剧烈,有白雾产生 | |
浓盐酸 | III.钠浮在液面,反应比Ⅰ缓慢,产生大量白雾,烧杯底部有白色固体 | |
下列说法不正确的是
A.II中反应的离子方程式为2Na + 2H+ === 2Na+ + H2↑
B.对比I、II、III可知,随着c(H+) 增大,反应的剧烈程度增大
C.实验I、II、III均有白雾产生,说明Na与水或酸反应均放出大量热
D.推测III中浓盐酸的c(Cl-)以及生成的NaCl固体对反应剧烈程度有影响
【题目】下列实验方案中,不能达到相应实验目的的是
A | B | C | D | |
方 案 |
|
|
|
|
目 的 | 验证不同催化剂对化学反应速率的影响 | 验证石蜡油分解的产物中含有与烷烃性质不同的烃 | 除去乙烯、甲烷混合气中的乙烯 | 比较Cl2、I2的氧化性 |
A. A B. B C. C D. D
【题目】乙烯是一种重要的基本化工原料,实验小组同学欲制备乙烯并验证其与溴单质的反应类型为加成反应。
I.乙烯的制备
欲利用下图所给装置制备乙烯。反应原理为:CH3CH2OH ![]() CH2=CH2↑+H2O,反应过程中观察到蒸馏烧瓶中溶液逐渐变黑。
CH2=CH2↑+H2O,反应过程中观察到蒸馏烧瓶中溶液逐渐变黑。
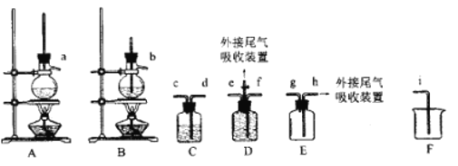
(1)欲收集一瓶乙烯,选择上图中的装置,其连接顺序为_____(按气流方向,用小写字母表示)。
(2)C中盛放的试剂为______,其作用为_____。
(3)在烧杯中混合浓硫酸和乙醇时,应先添加___;实验开始一段时间后发现忘记加碎瓷片,此时应该进行的操作为____。
(4)尾气吸收可采用________(填选项字母)。
A.KMnO4酸性溶液 B.浓硫酸 C.饱和Na2CO3溶液 D.NaOH溶液
II.验证乙烯与溴单质的反应类型为加成反应。
实验小组同学将I中制得的乙烯干燥后,按下列两种方案进行实验。
方案 | 操作 | 现象 |
一 | 将纯净的乙烯通入溴水中 | 溴水褪色 |
二 | 向充满纯净乙烯的塑料瓶中注入适量溴的CC14溶液,振荡 | ①溴的CCl4溶液褪色 ② |
(5)乙烯与溴单质发生加成反应的化学方程式为_________。
(6)方案一不能证明乙烯与溴单质发生了加成反应,原因为_________。
(7)方案二中现象②应为______,要想用此方案证明乙烯与溴单质发生的反应是加成反应,还需补充的实验为:继续向方案二塑料瓶中加入少量______,振荡后,若_____,证明发生了加成反应。