题目内容
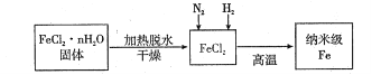
【题目】根据下图所示的过程中的能量变化情况,判断下列说法正确的是

A. N2(g)转化为氮原子是一个放热过程
B. 1mol N2和lmol O2的总能量比2molNO的总能量高
C. 1个NO(g)分子中的化学键断裂时需要吸收632kJ能量
D. 2NO(g)=N2(g)+O2(g)的反应热△H=-180 kJ/ mol
【答案】D
【解析】
A.N2(g)转化为氮原子,断裂N≡N,吸收热量,A错误;
B.由图中数据可知,断键吸收能量为(946+498)kJ=1444kJ,反应放出能量为2×632kJ=1264kJ,吸收能量多于放出能量,所以该反应为吸热反应,则1molN2和1molO2的总能量比2molNO的总能量低,B错误;
C.1 mol NO(g)分子中的化学键断裂时需要吸收632 kJ能量,C错误;
D.由上述分析可知,2NO(g)=N2(g)+O2(g)的反应热△H=-180kJ/mol,D正确;
故合理选项是D。

【题目】硫酸镁在医疗上具有镇静、抗挛等功效。以菱镁矿(主要成分是MgCO3)为主要原料制备硫酸镁的方法如下:
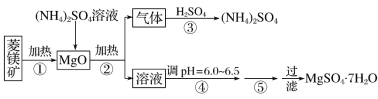
(1)步骤②中发生反应的离子方程式为__________________________________________。
(2)步骤④中调节pH=6.0~6.5的目的是_______________________________________。
(3)步骤⑤的操作为________________________________________________________。
(4)若要除去MgSO4溶液中的FeSO4应先加________,再加入过量__________,过滤即可把杂质除尽;请用离子方程式以及文字说明除杂原理___________________________________
(5)已知酸碱指示剂百里酚蓝变色的pH范围如表所示:
pH | <8.0 | 8.0~9.6 | >9.6 |
颜色 | 黄色 | 绿色 | 蓝色 |
25 ℃时,向Mg(OH)2的饱和溶液中滴加2滴百里酚蓝指示剂,溶液所呈现的颜色为____________(已知25 ℃时 ,Ksp[Mg(OH)2]=5.6×10-12 )。