题目内容
【题目】CO2的综合利用对温室气体的减排以及对减缓燃料危机等具有重要意义。
(1)CH4-CO2催化重整反应为:CH4(g)+CO2(g)=2CO(g)+2H2(g)。
已知:C(s)+2H2(g)=CH4(g) ΔH=-75kJ·mol-1
C(s)+O2(g)=CO2(g) ΔH=-394kJ·mol-1
C(s)+![]() O2(g)=CO(g) ΔH=111kJ·mol-1
O2(g)=CO(g) ΔH=111kJ·mol-1
该催化重整反应的ΔH=____kJ·mol-1。
(2)CH4-CO2催化重整反应通过热力学计算可得到的图像之一如图。
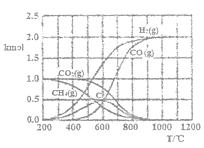
①200—400℃时,主要发生的反应的化学方程式为___。
②当温度高于600℃时,随着温度的升高C的物质的量减少,其原因是__(用文字表达)。
(3)辅助的Al-CO2电池工作原理如图所示。该电池电容量大,能有效利用CO2,电池反应产物Al2(C2O4)3是重要的化工原料。
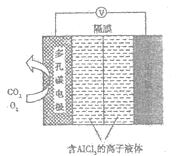
电池的正极反应式:6O2+6e-=6O2-,6CO2+6O2-=3C2O![]() +6O2。
+6O2。
反应过程中O2的作用是___。电池的负极反应式为___。
(4)以TiO2/Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率的关系如题图所示。
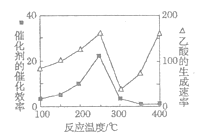
①Cu2Al2O4可溶于稀硝酸,该反应的离子方程式为___。
②300~400℃时,乙酸的生成速率升高的原因是____。
【答案】+247 CH4![]() C+2H2 600℃以上,C与CO2反应生成CO 催化作用 Al-3e-=Al3+ 3Cu2Al2O4+32H++2NO
C+2H2 600℃以上,C与CO2反应生成CO 催化作用 Al-3e-=Al3+ 3Cu2Al2O4+32H++2NO![]() =6Cu2++6Al3++2NO↑+26H2O 300℃~400℃催化剂几乎失去催化效率,温度升高加快化学反应速率
=6Cu2++6Al3++2NO↑+26H2O 300℃~400℃催化剂几乎失去催化效率,温度升高加快化学反应速率
【解析】
(1)已知:①C(s)+2H2(g)=CH4(g) ΔH=-75kJ·mol-1
②C(s)+O2(g)=CO2(g) ΔH=-394kJ·mol-1
③C(s)+![]() O2(g)=CO(g) ΔH=111kJ·mol-1
O2(g)=CO(g) ΔH=111kJ·mol-1
根据盖斯定律③×2-②-①即得到该催化重整反应的ΔH=+247kJ·mol-1。
(2)①根据图像可知200~400℃时甲烷分解生成氢气和碳,主要发生的反应的化学方程式为CH4![]() C+2H2。
C+2H2。
②由于600℃以上,C与CO2反应生成CO,所以当温度高于600℃时,随着温度的升高C的物质的量减少。
(3)由于电池的正极反应式为:6O2+6e-=6O2-,6CO2+6O2-=3C2O![]() +6O2,这说明反应前消耗氧气,最后又产生氧气,则反应过程中O2的作用是催化作用。负极铝失去电子,则电池的负极反应式为Al-3e-=Al3+;
+6O2,这说明反应前消耗氧气,最后又产生氧气,则反应过程中O2的作用是催化作用。负极铝失去电子,则电池的负极反应式为Al-3e-=Al3+;
(4)①Cu2Al2O4可溶于稀硝酸生成硝酸铜、硝酸铝、一氧化氮和水,该反应的离子方程式为3Cu2Al2O4+32H++2NO![]() =6Cu2++6Al3++2NO↑+26H2O。
=6Cu2++6Al3++2NO↑+26H2O。
②根据图像可知300℃~400℃时催化剂几乎失去催化效率,温度升高加快化学反应速率,所以300~400℃时,乙酸的生成速率升高。

 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案【题目】某研究小组在电压为24V时进行如下实验,电解3分钟后,发现下列现象。
编号 | ① | ② | ③ |
装置 |
|
|
|
现象 | 小灯泡微弱发光,两极均产生气泡,阳极附近出现白色浑浊,阴极附近无明显变化 | 两极均产生气泡,溶液无明显变化 | 两极均产生气泡,阳极附近出现白色浑浊,阴极附近无明显变化 |
下列说法正确的是( )
A.①中小灯泡微亮是因为Ca(OH)2是弱电解质
B.对比①和②,白色浑浊的出现与电极材料无关
C.对比①和③,白色浑浊是由于OH-迁移到阳极使Ca(OH)2沉淀析出
D.阳极附近白色沉淀的成分可能是CaCO3
【题目】硼酸(H3BO3)溶液中存在:H3BO3(aq)+H2O(l)![]() [B(OH)4]-(aq)+H+(aq)。下列说法正确的是
[B(OH)4]-(aq)+H+(aq)。下列说法正确的是
化学式 | 电离常数(298K) |
硼酸 | K=5.7×10-10 |
碳酸 | K1=4.4×10-7 K2=4.7×10-11 |
醋酸 | K=1.75×10-5 |
A.等物质的量浓度的碳酸钠溶液和醋酸钠溶液比较,pH:前者>后者
B.等物质的量浓度的碳酸溶液和硼酸溶液比较,pH:前者>后者
C.将一滴碳酸钠溶液滴入硼酸溶液中一定能观察到有气泡产生
D.将一滴醋酸溶液滴入碳酸钠溶液中一定能观察到有气泡产生