题目内容
5.N2在诸多领域用途广泛.某化学兴趣小组为探究在实验室制备较为纯净N2的方法,进行了认真的准备.请你参与交流与讨论.【查阅资料】N2的制法有下列三种方案:
方案1:加热NaNO2和NH4Cl的浓溶液制得N2.
方案2:加热条件下,以NH3还原CuO可制得N2,同时获得活性铜粉.
方案3:将空气缓缓通过灼热的铜粉获得较纯的N2.
【实验准备】以实验室常见仪器(药品)等设计的部分装置如图(有的夹持和加热仪器未画出).
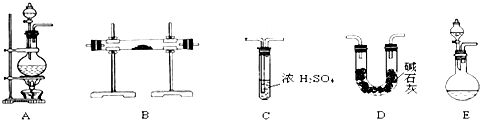
【分析交流】
(1)若以方案1制得N2,应选择的发生装置是A.
(2)若以方案2制得干燥、纯净的N2,且需要的NH3以生石灰和浓氨水作原料,整套制气装置按气流从左到右的连接顺序是E→D→B→C(填写序号).获得N2的反应原理是2NH3+3CuO$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+N2↑+3H2O(写反应方程式).
分析 (1)方案1制备氮气,为液体加热制备气体,据此选择发生装置;
(2)若以方案2制得干燥、纯净的N2,用生石灰和浓氨水作原料制取氨气,需选择固体和液体不需要加热制取气体的装置,提供的装置E符合条件,利用碱石灰干燥氨气,干燥的氨气与CuO在B装置中反应得到氮气,利用浓硫酸吸收未反应的氨气及反应生成的水;
由题目信息可知,氨气与氧化铜在加热条件下反应生成Cu、氮气,根据元素守恒,还有水生成.
解答 解:(1)方案1制备氮气,为液体加热制备气体,题目提供的发生装置中A符合,故选:A;
(2)若以方案2制得干燥、纯净的N2,用生石灰和浓氨水作原料制取氨气,需选择固体和液体不需要加热制取气体的装置,提供的装置E符合条件,利用碱石灰干燥氨气,干燥的氨气与CuO在B装置中反应得到氮气,利用浓硫酸吸收未反应的氨气及反应生成的水,故整套制气装置按气流从左到右的连接顺序是:E→D→B→C;
由题目信息可知,氨气与氧化铜在加热条件下反应生成Cu、氮气,根据元素守恒,还有水生成,获得N2的反应原理是:2NH3+3CuO$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+N2↑+3H2O.
故答案为:E→D→B→C;2NH3+3CuO$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+N2↑+3H2O.
点评 本题考查化学实验方案设计,设计制备原理、干燥净化、装置选择,明确制备流程为解题关键,是对学生综合能力的考查,题目难度中等.

练习册系列答案
相关题目
8.下列有关元素的性质及其递变规律正确的是( )
| A. | IA族与 VIIA族元素间可形成共价化合物或离子化合物 | |
| B. | 最高第二周期元素从左到右,正价从+1递增到+7 | |
| C. | 同主族元素的简单阴离子还原性越强,非金属性越强 | |
| D. | 同周期金属元素的化合价越高,其原子失电子能力越强 |
9.下列化合物分之中的所有原子都处于同一平面的是( )
| A. | 溴苯 | B. | 对二甲苯 | C. | 乙烷 | D. | 丙烯 |
20.在可逆反应2A(g)+3B(g)?xC(g)+D(g)中,已知:反应开始加入的物质只有A、B,起始浓度A为5mol•L-1,B为3mol•L-1,前2min C的平均反应速率为0.5mol•L-1•min-1.2min末,测得D的浓度为0.5mol•L-1.则关于此反应的下列说法中正确的是( )
| A. | 2 min末时A和B的浓度之比为5:3 | |
| B. | x=1 | |
| C. | 2 min末时B的浓度为1.5 mol•L-1 | |
| D. | 前2 min,A的消耗浓度为0.5 mol•L-1 |
17.下列说法中正确的是 ( )
| A. | 8NH3(g)+6NO2(g)═7N2(g)+12H2O(g)△H<0,则该反应一定能自发进行 | |
| B. | 常温下,pH均为5的盐酸与氯化铵溶液中,水的电离程度相同 | |
| C. | 催化剂可以加快化学反应速率,也能增大化学反应的焓变 | |
| D. | NH3•H2O溶液加水稀释后,溶液中Kw的值增大. |
14.反应N2+3H2=2NH3的能量变化如图,其热化学方程式正确的是( )
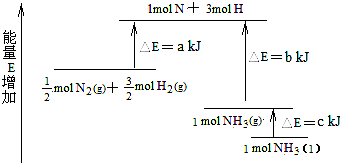
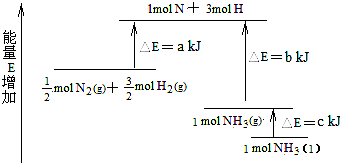
| A. | N2(g)+H2(g)=NH3(l)△H=+(b+c-a)kJ•mol-1 | |
| B. | N2(g)+3H2(g)=2NH3(g)△H=+2(b-a)kJ•mol-1 | |
| C. | N2(g)+3H2(g)=2NH3(l)△H=-2(b+c-a)kJ•mol-1 | |
| D. | N2(g)+H2(g)=NH3(g)△H=+(a+b)kJ•mol-1 |
 实验题(一)在实验室配制100mL0.5mol/L的Na2CO3溶液,请回答下列问题
实验题(一)在实验室配制100mL0.5mol/L的Na2CO3溶液,请回答下列问题 在分析化学中常用Na2C2O4晶体(溶液无色)作为基准物质测定KMnO4溶液的浓度.在H2SO4溶液中,反应如下:2MnO${\;}_{4}^{-}$+5C2O${\;}_{4}^{2-}$+16H+$\frac{\underline{\;75℃-85℃\;}}{\;}$2Mn2+(溶液无色)+10CO2↑+8H2O.
在分析化学中常用Na2C2O4晶体(溶液无色)作为基准物质测定KMnO4溶液的浓度.在H2SO4溶液中,反应如下:2MnO${\;}_{4}^{-}$+5C2O${\;}_{4}^{2-}$+16H+$\frac{\underline{\;75℃-85℃\;}}{\;}$2Mn2+(溶液无色)+10CO2↑+8H2O.