题目内容
8.乙酰基二茂铁是常用火箭燃料的添加剂、汽油抗暴剂等,由二茂铁合成乙酰基二茂铁的原理如图1: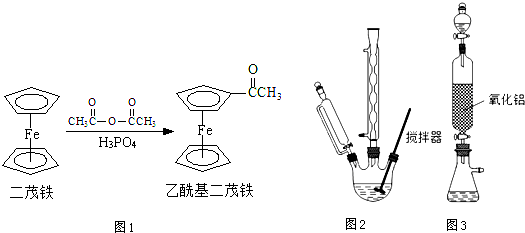
已知乙醚的沸点34.6℃,其合成与分离提纯装置如图2、3.实验步骤如下:
步骤①:如图2所示,将1g二茂铁与3mL乙酸酐加入已经干燥三颈烧瓶中,在搅拌下慢慢滴加磷酸1mL,加热回流5分钟.
步骤②:将反应液倒入烧杯,再加入10g碎冰,在搅拌下缓慢滴加NaHCO3溶液中和至中性左右,置于冰水浴中15min.抽滤,烘干,得到乙酰基二茂铁粗产品.
步骤③:将粗产品溶解在苯中,从图3装置的分液漏斗中滴下,再用乙醚淋洗.
步骤④:将其中一段时间的淋洗液收集,并进行操作X,得到纯净的针状晶体乙酰基二茂铁并回收乙醚.
(1)合成过程中要求无水操作,理由是防止乙酸酐水解.
(2)步骤②中的抽滤操作,除烧杯、玻璃棒、安全瓶外,还必须使用的属于硅酸盐材质的仪器有布氏漏斗、抽滤瓶.
(3)步骤②中缓慢滴加不需要测定溶液的pH就可以判断溶液接近中性,其现象是滴加NaHCO3溶液不再产生气泡,缓慢滴加的理由是防止产生CO2速率太快,将液体冲出烧杯.
(4)步骤③将粗产品中杂质分离实验的原理是不同物质在扩散剂中扩散的速率不同.
(5)步骤④中操作X的名称是蒸馏,操作X中使用的加热方式最好是水浴加热.
(6)为确定产品乙酰基二茂铁中是否含有杂质二乙酰基二茂铁(
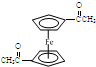 ),可以使用的仪器分析方法是质谱法或核磁共振氢谱.
),可以使用的仪器分析方法是质谱法或核磁共振氢谱.
分析 (1)依据乙酸酐易水解分析;
(2)抽滤操作,需用到烧杯、玻璃棒、安全瓶、布氏漏斗和抽滤瓶等仪器;
(3)酸能和碳酸氢钠反应生成CO2气体,故滴加NaHCO3溶液不再产生气泡时可以说明溶液接近中性;缓慢滴加是防止反应速率太快;
(4)不同物质在扩散剂中扩散的速率不同;
(5)得到纯净的针状晶体乙酰基二茂铁并回收乙醚,应进行蒸馏;乙醚沸点较低,应用水浴加热;
(6)可用质谱法或核磁共振氢谱确定有机物的结构.
解答 解:(1)由于乙酸酐极易水解,故合成过程中要求无水操作,防止乙酸酐水解;
故答案为:防止乙酸酐水解;
(2)抽滤操作,需用到烧杯、玻璃棒、安全瓶、布氏漏斗和抽滤瓶等仪器,
故答案为:布氏漏斗、抽滤瓶;
(3)酸能和碳酸氢钠反应生成CO2气体,故滴加NaHCO3溶液不再产生气泡时可以说明溶液接近中性;
缓慢滴加是防止产生CO2速率太快,将液体冲出烧杯;
故答案为:滴加NaHCO3溶液不再产生气泡;防止产生CO2速率太快,将液体冲出烧杯;
(4)不同物质在扩散剂中扩散的速率不同,故可以使用层析法进行分离,
故答案为:不同物质在扩散剂中扩散的速率不同;
(5)由于有机物之间的溶解性大,但沸点相差较大,所以X的操作名称应该是蒸馏;
乙醚沸点较低,故应用水浴加热,
故答案为:蒸馏;水浴加热;
(6)由于乙酰基二茂铁和二乙酰基二茂铁的结构不同,相对分子质量不同,但都含有相同的官能团,所以可以使用的仪器分析方法是质谱法或核磁共振氢谱,
故答案为:质谱法或核磁共振氢谱.
点评 本题以乙酰基二茂铁为载体考查化学基本实验操作、仪器的选择、物质的分离和提纯以及有机物结构的鉴别,是高考中的常见考点和题型,难度中等.侧重考查学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
12.如图是部分短周期主族元素原子半径与原子序数的关系图,下列说法正确的是( )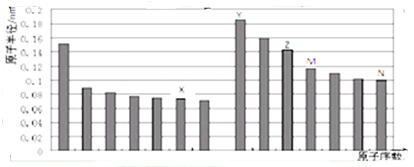

| A. | 金属性:Z>Y | |
| B. | 气态氢化物的稳定性:M>N | |
| C. | X和Y形成的化合物中可能含共价键 | |
| D. | Z元素的离子半径是本周期元素离子半径最小的 |
9.下列化合物分之中的所有原子都处于同一平面的是( )
| A. | 溴苯 | B. | 对二甲苯 | C. | 乙烷 | D. | 丙烯 |
3.为研究铁及其化合物的性质,某探究小组进行如下实验:将一表面有铁锈(Fe2O3)的铁钉浸泡在稀硫酸中一段时间,取适量浸泡后的溶液滴入少量KSCN溶液,未见溶液呈血红色.请根据要求回答问题:
(1)甲同学认为:“将一表面有铁锈(Fe2O3)的铁钉浸泡在稀硫酸中一段时间”,体系中不仅铁锈、铁与稀硫酸发生了反应,同时还发生另一个反应.
①铁锈与稀硫酸反应的化学方程式为Fe2O3+3H2SO4=Fe2(SO4)3+3H2O.
②“还发生另一个反应”对应的离子方程式应为Fe+2Fe3+=3Fe2+.
(2)现有下列仪器和试剂,若要通过实验验证甲同学的分析是否正确,你将设计怎样的实验方案?请将你设计的方案填入下列表格中.
仪器:试管、胶头滴管
试剂:氯水、稀硫酸、铁粉、硫氰酸钾溶液
(1)甲同学认为:“将一表面有铁锈(Fe2O3)的铁钉浸泡在稀硫酸中一段时间”,体系中不仅铁锈、铁与稀硫酸发生了反应,同时还发生另一个反应.
①铁锈与稀硫酸反应的化学方程式为Fe2O3+3H2SO4=Fe2(SO4)3+3H2O.
②“还发生另一个反应”对应的离子方程式应为Fe+2Fe3+=3Fe2+.
(2)现有下列仪器和试剂,若要通过实验验证甲同学的分析是否正确,你将设计怎样的实验方案?请将你设计的方案填入下列表格中.
仪器:试管、胶头滴管
试剂:氯水、稀硫酸、铁粉、硫氰酸钾溶液
| 实验操作 | 实验现象 | 实验结论 |
| 取适量铁钉与稀硫酸浸泡后的溶液于试管中,依次滴入适量的氯水和几滴KSCN溶液,振荡. | 溶液呈血红色 | 乙同学的观点正确 (填“正确”或“错误”). |
20.在可逆反应2A(g)+3B(g)?xC(g)+D(g)中,已知:反应开始加入的物质只有A、B,起始浓度A为5mol•L-1,B为3mol•L-1,前2min C的平均反应速率为0.5mol•L-1•min-1.2min末,测得D的浓度为0.5mol•L-1.则关于此反应的下列说法中正确的是( )
| A. | 2 min末时A和B的浓度之比为5:3 | |
| B. | x=1 | |
| C. | 2 min末时B的浓度为1.5 mol•L-1 | |
| D. | 前2 min,A的消耗浓度为0.5 mol•L-1 |
17.下列说法中正确的是 ( )
| A. | 8NH3(g)+6NO2(g)═7N2(g)+12H2O(g)△H<0,则该反应一定能自发进行 | |
| B. | 常温下,pH均为5的盐酸与氯化铵溶液中,水的电离程度相同 | |
| C. | 催化剂可以加快化学反应速率,也能增大化学反应的焓变 | |
| D. | NH3•H2O溶液加水稀释后,溶液中Kw的值增大. |
18.下列各组物质之间的反应,反应产物一定为纯净物的是( )
| A. | 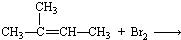 | B. | 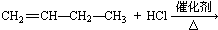 | ||
| C. | 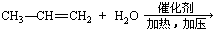 | D. | 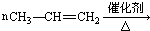 |
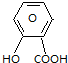 $\stackrel{NaHCO_{3}溶液}{→}$X$\stackrel{NaOH溶液}{→}$Y$\stackrel{CO_{2}}{→}$Z$\stackrel{HCl}{→}$M$→_{浓H_{2}SO_{4}△}^{CH_{3}OH酯化}$N
$\stackrel{NaHCO_{3}溶液}{→}$X$\stackrel{NaOH溶液}{→}$Y$\stackrel{CO_{2}}{→}$Z$\stackrel{HCl}{→}$M$→_{浓H_{2}SO_{4}△}^{CH_{3}OH酯化}$N ,Y
,Y ,Z
,Z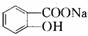 ,M
,M ,N
,N .
. 实验题(一)在实验室配制100mL0.5mol/L的Na2CO3溶液,请回答下列问题
实验题(一)在实验室配制100mL0.5mol/L的Na2CO3溶液,请回答下列问题