题目内容
20.已知在水溶液中,Cr2O72-离子呈红色,CrO42-离子呈黄色,Cr3+离子呈绿色,当K2Cr2O7溶液溶于水时,有下列平衡存在:Cr2O72-+H2O?2CrO42-+2H+.试回答:(1)若往K2CrO4溶液里加硫酸溶液,观察到的现象是溶液黄色变为红色.
(2)若往(1)所得溶液里通入H2S气体,观察到溶液呈绿色,并有浅黄色沉淀生成,其反应的离子方程式为8H++Cr2O72-+3H2S=2Cr3++3S↓+7H2O.
(3)另取一份K2Cr2O7,滴入NaOH溶液,其现象是溶液红色变为黄色,此时溶液中离子浓度下降的是Cr2O72-、H+.
分析 (1)根据氢离子浓度增加对化学平衡移动的影响来回答;
(2)硫化氢可以被Cr2O72-离子氧化为硫单质,同时得到还原产物Cr3+离子而呈绿色,据此书写方程式;
(3)加入少量NaOH固体,中和氢离子,氢离子浓度降低,平衡向右移动,据此回答判断.
解答 解:(1)氢离子浓度增加,化学平衡逆向移动,溶液黄色变为红色,故答案为:溶液黄色变为红色;
(2)硫化氢可以被Cr2O72-离子氧化为硫单质,同时得到还原产物Cr3+离子而呈绿色,化学方程式为:8H++Cr2O72-+3H2S=2Cr3++3S↓+7H2O,
故答案为:8H++Cr2O72-+3H2S=2Cr3++3S↓+7H2O;
(3)加入少量NaOH固体,中和氢离子,氢离子浓度降低,平衡向右移动,溶液红色变为黄色,溶液中Cr2O72-、H+离子浓度下降,故答案为:溶液红色变为黄色;Cr2O72-、H+.
点评 本题考查学生影响化学平衡移动的因素知识,注意平衡移动原理的应用是关键,难度不大.

练习册系列答案
相关题目
10.最近医学界通过用14C标记的C60发现一种C60的羧酸衍生物,在特定条件下可以通过断裂DNA抑制艾滋病毒的繁殖,则有关14C的不正确叙述是( )
| A. | 14C与12C60中碳原子化学性质相同 | B. | 14C与14N的质量数相同 | ||
| C. | 14C是12C60的同素异形体 | D. | 14C与12C、13C互为同位素 |
8.下列有关元素的性质及其递变规律正确的是( )
| A. | IA族与 VIIA族元素间可形成共价化合物或离子化合物 | |
| B. | 最高第二周期元素从左到右,正价从+1递增到+7 | |
| C. | 同主族元素的简单阴离子还原性越强,非金属性越强 | |
| D. | 同周期金属元素的化合价越高,其原子失电子能力越强 |
15.已知短周期元素a、b、c、d、e的原子序数依次增大、其氢化物中a、b、c、d、e的化合价如表,下列说法不正确的是( )
| 元素 | a | b | c | d | e |
| 化合价 | -4 | +1 | -4 | -2 | -1 |
| A. | 元素a、c、d的最高价氧化物都属于酸性氧化物 | |
| B. | 元素c、d、e的氢化物稳定性和最高价氧化物对应水化物的酸性均依次增强 | |
| C. | 元素周期表中,元素c位于金属和非金属分界线附近,其单质常用作光电池材料 | |
| D. | 元素b、d、e的原子半径和离子半径均依次减小 |
5. 如图是周期表中短周期的一部分.已知Y和W原子能形成两种造成酸雨的有害气体,则下列说法中不正确的是( )
如图是周期表中短周期的一部分.已知Y和W原子能形成两种造成酸雨的有害气体,则下列说法中不正确的是( )
 如图是周期表中短周期的一部分.已知Y和W原子能形成两种造成酸雨的有害气体,则下列说法中不正确的是( )
如图是周期表中短周期的一部分.已知Y和W原子能形成两种造成酸雨的有害气体,则下列说法中不正确的是( )| A. | 原子半径的大小顺序是W>Y>Z | |
| B. | X的氢化物没有Z的氢化物稳定 | |
| C. | 常见的Y的氢化物具有正四面体结构 | |
| D. | Y的氢化物比W的氢化物沸点高,是因为分子间存在氢键 |
12.如图是部分短周期主族元素原子半径与原子序数的关系图,下列说法正确的是( )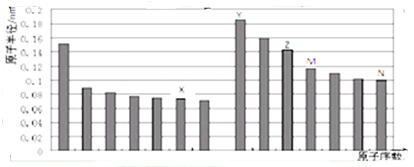

| A. | 金属性:Z>Y | |
| B. | 气态氢化物的稳定性:M>N | |
| C. | X和Y形成的化合物中可能含共价键 | |
| D. | Z元素的离子半径是本周期元素离子半径最小的 |
9.下列化合物分之中的所有原子都处于同一平面的是( )
| A. | 溴苯 | B. | 对二甲苯 | C. | 乙烷 | D. | 丙烯 |
17.下列说法中正确的是 ( )
| A. | 8NH3(g)+6NO2(g)═7N2(g)+12H2O(g)△H<0,则该反应一定能自发进行 | |
| B. | 常温下,pH均为5的盐酸与氯化铵溶液中,水的电离程度相同 | |
| C. | 催化剂可以加快化学反应速率,也能增大化学反应的焓变 | |
| D. | NH3•H2O溶液加水稀释后,溶液中Kw的值增大. |
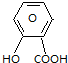 $\stackrel{NaHCO_{3}溶液}{→}$X$\stackrel{NaOH溶液}{→}$Y$\stackrel{CO_{2}}{→}$Z$\stackrel{HCl}{→}$M$→_{浓H_{2}SO_{4}△}^{CH_{3}OH酯化}$N
$\stackrel{NaHCO_{3}溶液}{→}$X$\stackrel{NaOH溶液}{→}$Y$\stackrel{CO_{2}}{→}$Z$\stackrel{HCl}{→}$M$→_{浓H_{2}SO_{4}△}^{CH_{3}OH酯化}$N ,Y
,Y ,Z
,Z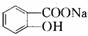 ,M
,M ,N
,N .
.