题目内容
7.下列有关金属及其合金的说法正确的是( )| A. | 锂与氧气反应时,反应条件不同产物不同 | |
| B. | 铝箔在空气中受热可以熔化且会发生剧烈燃烧 | |
| C. | 合金的熔点比其成分金属的熔点低,所以钾钠合金可以做原子反应堆的导热剂 | |
| D. | 合金中至少含两种金属 |
分析 A.金属锂与氧气反应只有一种产物氧化锂;
B.因铝与氧气反应生成氧化铝为致密的氧化物,则不会剧烈燃烧;
C.合金的熔点比其成分金属的熔点低,76%K与24%钠的合金在-12.6℃凝固,比钾和钠的熔点(63.5℃和97.9℃)都低,钠和钾的合金可作原子反应堆的导热剂;
D.根据合金的定义分析,合金中至少有一种金属;
解答 解:A.金属锂与氧气反应只有一种产物氧化锂:Li2O,故A错误;
B.铝与氧气反应生成氧化铝为致密的氧化物,阻止反应的进一步发生,则不会剧烈燃烧,铝箔在空气中受热熔化只是金属发红,故B错误;
C.钠和钾的合金熔点低,常温下为液态,具有良好的导热性,可作原子反应堆的导热剂,故C正确;
D.合金中必须有一种金属,另外的可能是金属也可能是非金属,所以至少有一种金属,故D错误;
故选C.
点评 本题考查有关金属及其合金的知识,根据锂及铝的性质及合金的概念来分析解答,注意合金的概念及其应用,题目难度不大.

练习册系列答案
 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案
相关题目
17.下列说法中正确的是 ( )
| A. | 8NH3(g)+6NO2(g)═7N2(g)+12H2O(g)△H<0,则该反应一定能自发进行 | |
| B. | 常温下,pH均为5的盐酸与氯化铵溶液中,水的电离程度相同 | |
| C. | 催化剂可以加快化学反应速率,也能增大化学反应的焓变 | |
| D. | NH3•H2O溶液加水稀释后,溶液中Kw的值增大. |
18.下列各组物质之间的反应,反应产物一定为纯净物的是( )
| A. | 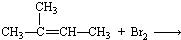 | B. | 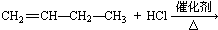 | ||
| C. | 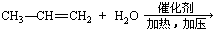 | D. | 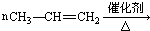 |
2.下列关于热化学反应的描述中正确的是( )
| A. | 已知H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ/mol,则H2SO4和Ba(OH)2反应的反应热△H=2×(-57.3)kJ/mol | |
| B. | 燃料电池中将甲醇蒸气转化为氢气的热化学方程式是CH3OH(g)+$\frac{1}{2}$O2(g)═CO2(g)+2H2 (g)△H=-192.9 kJ/mol,则CH3OH(g)的燃烧热△H=-192.9 kJ/mol | |
| C. | H2(g)的燃烧热△H=-285.8 kJ/mol,则2H2O(g)═2H2(g)+O2(g)△H=+571.6 kJ/mol | |
| D. | 葡萄糖的燃烧热△H=-2800 kJ/mol,则 $\frac{1}{2}$C6H12O6(s)+3O2(g)═3CO2(g)+3H2O(l)△H=-1400 kJ/mol |
12.某待测溶液中可能含有SO42-、SO32-、CO32-、HCO3-、NO3-、Cl-、Br-中的若干种及一种常见金属阳离子(Mn+),现进行如下实验(每次实验所用试剂均是足量的,鉴定中某些成分可能没有给出).
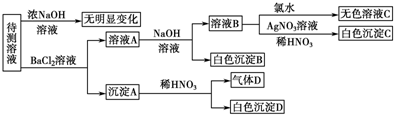
请回答下列问题:(1)根据上述框图信息填写下表(不能确定的不填):
(2)写出沉淀A三种可能的情况:BaSO3;BaSO3、BaSO4;BaCO3、BaSO4;BaCO3、BaSO3;BaSO3、BaCO3、BaSO4;,若气体D遇空气变红棕色,则生成沉淀D时肯定发生的反应的离子方程式为3BaSO3+2H++2NO3-═2NO↑+3BaSO4↓+H2O.
(3)若Mn+位于第三周期,则要确定它具体是何种离子的方法是做焰色反应实验,观察到黄色火焰,则说明是钠.

请回答下列问题:(1)根据上述框图信息填写下表(不能确定的不填):
| 肯定存在的离子 | 肯定没有的离子 | |
| 化学式或离子符号 |
(3)若Mn+位于第三周期,则要确定它具体是何种离子的方法是做焰色反应实验,观察到黄色火焰,则说明是钠.
19.将2.0mol SO2气体和2.0mol SO3气体混合于固定体积的密闭容器中,在一定条件下发生反应:2SO2(g)+O2(g)?2SO3(g),达到平衡时SO3为n mol.在相同温度下,分别按下列配比在相同密闭容器中放入起始物质,平衡时SO3等于n mol的是( )
| A. | 1.6 mol SO2+0.3 mol O2+0.4 mol SO3 | |
| B. | 4.0 mol SO2+1.0 mol O2 | |
| C. | 2.0 mol SO2+1.0 mol O2+2.0 mol SO3 | |
| D. | 3.0 mol SO2+1.0 mol O2+1.0 mol SO3 |
16.在溶液(NH4)2SO4中,离子浓度大小顺序正确的是( )
| A. | c(NH4+)>c(SO42-)>c(H+)>c(OH-) | B. | c(SO42-)>c(NH4+)>c(OH-)>c(H+) | ||
| C. | c(NH4+)>c(SO42)>c(OH-)>c(H+) | D. | c(SO42-)>c(H+)>c(NH4+)>c(OH-) |
17.一个原电池的总反应式为Fe+Cu2+=Fe2++Cu,该原电池的组成可能为( )
| A | B | C | D | |
| 正极 | Fe | C | Cu | Zn |
| 负极 | Cu | Fe | Fe | Fe |
| 电解质溶液 | CuSO4 | H2SO4 | CuCl2 | CuSO4 |
| A. | A | B. | B | C. | C | D. | D |