题目内容
12.钠、钾的碘化物在生产和科学实验中有十分重要的应用.工业利用碘、NaOH和铁屑为原料可生产碘化钠,其生产流程如图1: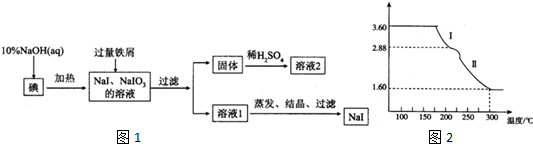
(1)NaOH溶液和碘反应时需要严格控制温度,如果温度过低,会生成碘的低价副产品NaIO.若NaOH溶液和碘反应时所得溶液中IO3-与IO-的物质的量之比为1:1,则该反应的离子方程式为4I2+8OH-=IO3-+IO-+6I-+4H2O.
(2)生产流程中加入过量铁屑的目的是将NaIO3完全转化为NaI,过滤所得固体中除剩余铁屑外,还有红褐色固体,则加入铁屑时发生反应的化学方程式是3H2O+2Fe+NaIO3=NaI+2Fe(OH)3↓.
(3)溶液2中除含有H+外,一定含有的阳离子是Fe2+;试设计实验证实该金属阳离子的存在取溶液少量加高锰酸钾溶液,若溶液褪色则含Fe2+,反之不含.
(4)溶液2经一系列转化可以得到草酸亚铁晶体(FeC2O4•2H2O),称取3.60g草酸亚铁晶体(相对分子质量是180)用热重法对其进行热分解,得到剩余固体的质量随温度变化的曲线如图2所示:1析图中数据,根据信息写出过程Ⅰ发生2的化学方程式FeC2O4•2H2O$\frac{\underline{\;\;△\;\;}}{\;}$FeC2O4+2H2O↑.
②300℃时剩余固体只有一种且是铁的氧化物,试通过计算确定该氧化物的化学式Fe2O3.
分析 由制备流程可知,碘与NaOH溶液反应生成NaI、NaIO3,加入Fe与NaIO3发生氧化还原反应生成NaI、氢氧化铁,经过滤后得到红褐色固体氢氧化铁,过滤后溶液中主要含NaI,分离、提纯得到NaI;
(1)生成IO3-与IO-,I元素的化合价均升高,则还生成NaI,结合电子、电荷守恒分析;
(2)Fe与NaIO3发生氧化还原反应;
(3)由溶液含H+,固体完全溶解,Fe与硫酸铁反应生成硫酸亚铁;
(4)①过程I使其质量减少3.60-2.88g=0.72g,恰好为0.4mol水的质量;
②由元素守恒计算氧化物中Fe元素的质量,再利用原子个数比确定化学式.
解答 解:(1)NaOH溶液和碘反应时所得溶液中IO3-与IO-的物质的量之比为1:1,若均为1mol,由电子守恒可知,生成I-为$\frac{1×5+1×1}{(1-0)}$=6mol,结合电荷守恒及原子守恒可知离子反应为4I2+8OH-=IO3-+IO-+6I-+4H2O,故答案为:4I2+8OH-=IO3-+IO-+6I-+4H2O;
(2)加入过量铁屑的目的是将NaIO3完全转化为NaI,加入铁屑时发生反应的化学方程式为3H2O+2Fe+NaIO3=NaI+2Fe(OH)3↓,
故答案为:将NaIO3完全转化为NaI;3H2O+2Fe+NaIO3=NaI+2Fe(OH)3↓;
(3)固体中除剩余铁屑外,还有红褐色固体,加硫酸得到溶液2除含有H+外,固体完全溶解,一定含有的阳离子是Fe2+,证实该金属阳离子的存在方法为取溶液少量加高锰酸钾溶液,若溶液褪色则含Fe2+,反之不含,
故答案为:Fe2+;取溶液少量加高锰酸钾溶液,若溶液褪色则含Fe2+,反之不含;
(4)①3.60g草酸亚铁晶体,物质的量为0.2mol,过程I使其质量减少3.60-2.88g=0.72g,恰好为0.4mol水的质量,则过程Ⅰ发生的反应是:草酸亚铁晶体受热失去结晶水,反应的化学方程式为:FeC2O4•2H2O$\frac{\underline{\;\;△\;\;}}{\;}$FeC2O4+2H2O↑,
故答案为:FeC2O4•2H2O$\frac{\underline{\;\;△\;\;}}{\;}$FeC2O4+2H2O↑;
②草酸亚铁晶体中的铁元素质量为:3.6g×$\frac{56}{180}$×100%=1.12g,草酸亚铁晶体中的铁元素完全转化到氧化物中,
氧化物中氧元素的质量为:1.60g-1.12g=0.48g,
铁元素和氧元素的质量比为:1.12g:0.48g=7:3,
设铁的氧化物的化学式为FexOy,
则56x:16y=7:3,
x:y=2:3,
铁的氧化物的化学式为Fe2O3,
故答案为:Fe2O3.
点评 本题考查制备实验方案的设计,为高频考点,把握制备流程中的反应及氧化还原反应的分析、质量守恒的计算等为解答的关键,侧重分析与应用能力的考查,综合性较强,题目难度中等.

 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案| 元素 | a | b | c | d | e |
| 化合价 | -4 | +1 | -4 | -2 | -1 |
| A. | 元素a、c、d的最高价氧化物都属于酸性氧化物 | |
| B. | 元素c、d、e的氢化物稳定性和最高价氧化物对应水化物的酸性均依次增强 | |
| C. | 元素周期表中,元素c位于金属和非金属分界线附近,其单质常用作光电池材料 | |
| D. | 元素b、d、e的原子半径和离子半径均依次减小 |
(1)甲同学认为:“将一表面有铁锈(Fe2O3)的铁钉浸泡在稀硫酸中一段时间”,体系中不仅铁锈、铁与稀硫酸发生了反应,同时还发生另一个反应.
①铁锈与稀硫酸反应的化学方程式为Fe2O3+3H2SO4=Fe2(SO4)3+3H2O.
②“还发生另一个反应”对应的离子方程式应为Fe+2Fe3+=3Fe2+.
(2)现有下列仪器和试剂,若要通过实验验证甲同学的分析是否正确,你将设计怎样的实验方案?请将你设计的方案填入下列表格中.
仪器:试管、胶头滴管
试剂:氯水、稀硫酸、铁粉、硫氰酸钾溶液
| 实验操作 | 实验现象 | 实验结论 |
| 取适量铁钉与稀硫酸浸泡后的溶液于试管中,依次滴入适量的氯水和几滴KSCN溶液,振荡. | 溶液呈血红色 | 乙同学的观点正确 (填“正确”或“错误”). |
| A. | 2 min末时A和B的浓度之比为5:3 | |
| B. | x=1 | |
| C. | 2 min末时B的浓度为1.5 mol•L-1 | |
| D. | 前2 min,A的消耗浓度为0.5 mol•L-1 |
| A. | 中和热测定实验中,缓慢地将NaOH溶液倒入测定装置中--测定结果无影响 | |
| B. | 酸碱中和滴定实验中,滴定前无气泡而滴定后有气泡_测定结果偏高 | |
| C. | 测定溶液pH的实验中,用干燥pH试纸测定新制氯水的pH--测定结果无影响 | |
| D. | 现需90mL 1.0mol•L-1NaOH溶液,称取3.6gNaOH固体配制--溶液浓度偏低 |
| A. | 8NH3(g)+6NO2(g)═7N2(g)+12H2O(g)△H<0,则该反应一定能自发进行 | |
| B. | 常温下,pH均为5的盐酸与氯化铵溶液中,水的电离程度相同 | |
| C. | 催化剂可以加快化学反应速率,也能增大化学反应的焓变 | |
| D. | NH3•H2O溶液加水稀释后,溶液中Kw的值增大. |
①液态水变成水蒸气; ②酸碱中和反应; ③浓H2SO4稀释;
④固体氢氧化钠溶于水; ⑤H2在Cl2中燃烧; ⑥弱酸电离;
⑦NH4Cl晶体与Ba(OH )2•8H2O混合搅拌.
| A. | ①③⑤ | B. | ①⑥⑦ | C. | ②④⑦ | D. | ②③④⑤ |
| A. | 已知H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ/mol,则H2SO4和Ba(OH)2反应的反应热△H=2×(-57.3)kJ/mol | |
| B. | 燃料电池中将甲醇蒸气转化为氢气的热化学方程式是CH3OH(g)+$\frac{1}{2}$O2(g)═CO2(g)+2H2 (g)△H=-192.9 kJ/mol,则CH3OH(g)的燃烧热△H=-192.9 kJ/mol | |
| C. | H2(g)的燃烧热△H=-285.8 kJ/mol,则2H2O(g)═2H2(g)+O2(g)△H=+571.6 kJ/mol | |
| D. | 葡萄糖的燃烧热△H=-2800 kJ/mol,则 $\frac{1}{2}$C6H12O6(s)+3O2(g)═3CO2(g)+3H2O(l)△H=-1400 kJ/mol |