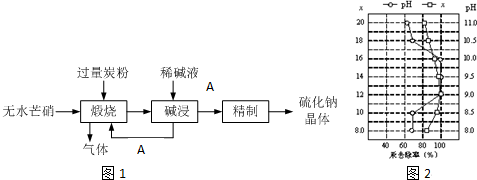
题目内容
13.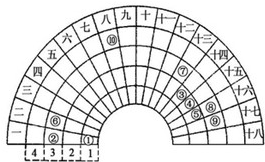 元素周期表的形式多种多样,如图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表思考扇形元素周期表的填充规律,请回答下列问题
元素周期表的形式多种多样,如图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表思考扇形元素周期表的填充规律,请回答下列问题(1)⑤、⑥、⑧对应原子半径⑥>⑧>⑤(用数字表示)
(2)写出元素④的氢化物和其最高价氧化物对应水化物反应的化学方程式:NH3+HNO3═NH4NO3
(3)若元素⑩是铁,写出其处于常见周期表的位置第四周期第VIII族
(4)元索②⑧组成A2B型化合物,用电子式表示该化含物的形成过程:
(5)将等物质的量的①、④的气体单质充入一密闭容器中,在适当催化剂和恒温、恒容条件下发生可逆反应,
△H<0,下列说法中,不正确的c、d(填选项序号)
a.达到化学平衡时,正反应速率与逆反应速率相等
b.达到化学平衡时,④的单质的体枳分数仍为50%
c.达到化学平衡的过程中,混合气体平均相对分子质量减小
d.达到化学平衡时,①、④的两种单质在混合气体中的物质的量之比仍为1:1.
分析 (1)电子层数越多,原子半径越大;电子层数相同时,核电荷数越大,原子半径越小.即“一层二核”;
(2)酸碱反应得到盐,氨气与硝酸反应得到硝酸铵;
(3)根据“周期数等于电子层数,副族族序数等于最外层和次外d能级的电子数之和”,铁元素是26号元素,在周期表中位置是:第四周期第VIII族;
(4)电子式是用“•”或“×”表示原子最外层电子.通过电子得失得到离子化合物;
(5)有关反应方程式为:N2(g)+3H2(g)=2NH3(g),
a、正反应速率与逆反应速率相等,反应达到平衡状态的标志;
b. 单质的体枳分数等于物质的量分数;根据三段法,表示出平衡时各组分物质的量,代入公式求出;
c.由公式M=$\frac{m}{n}$得,混合气体总质量不变,气体总物质的量减小,所以混合气体平均相对分子质量增加;
d.根据c项的三段法可知,达到化学平衡时,①、④的两种单质在混合气体中的物质的量之比 $\frac{a-x}{a-3x}$,不可能再是1:1.
解答 解:(1)电子层数越多,原子半径越大;电子层数相同时,核电荷数越大,原子半径越小.即“一层二核””⑥⑧都位于第三周期,有三个电子层,但⑧的核电荷数大于⑥所以原子半径⑥>⑧;⑤位于第二周期,有两个电子层,所以原子半径最小,
故答案为:⑥>⑧>⑤;
(2)根据题目信息,可知元素④第二周期第VA族,是氮元素,它的氢化物为NH3,最高价氧化物的水化物为HNO3,反应的化学方程式为:NH3+HNO3═NH4NO3,
故答案为:NH3+HNO3═NH4NO3;
(3)根据“周期数等于电子层数,副族族序数等于最外层和次外d能级的电子数之和”,铁元素是26号元素,在周期表中位置是:第四周期第VIII族.
故答案为:第四周期第VIII族;
(4)电子式是用“•”或“×”表示原子最外层电子.根据②⑧位置可知:②是钠元素,⑧为硫元素.二者通过电子得失形成离子化合物,用电子式表示该化含物的形成过程: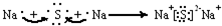 ,
,
故答案为: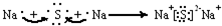 ;
;
(5)根据①、④位置可知①的单质为氢气,④的单质是氮气,反应方程式为:N2(g)+3H2(g)=2NH3(g),
a、正反应速率与逆反应速率相等,反应达到平衡状态的标志,故a正确;
b.设平衡时反应的N2的为x,则根据三段法得到如下:N2(g)+3H2(g)=2NH3(g)
起始物质的量:a a 0
变化物质的量:x 3x 2x
平衡时物质的量:a-x a-3x 2x
达到化学平衡时,④的单质的体枳分数等于物质的量分数=a-x $\frac{a-x}{a-x+a-3x+2x}$×100%=50%,故b正确;
c.根据方程式中的化学计量数1+3<2,可以看出此反应N2(g)+3H2(g)=2NH3(g)
是气体体积减小的反应,即气体总物质的量减小.由公式M=$\frac{m}{n}$得,混合气体总质量不变,气体总物质的量减小,所以混合气体平均相对分子质量增加,故c错误;
d.根据c项的三段法可以看出,达到化学平衡时,①、④的两种单质在混合气体中的物质的量之比 $\frac{a-x}{a-3x}$,不可能再是1:1,故d错误;
故答案为:c、d.
点评 熟记1-36号元素,依据元素性质,看清题意要求,灵活答题.

| A. | 常温下向饱和AgCl水溶液中加入盐酸,Ksp值变大 | |
| B. | 已知Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=9.0×10-12,在含Cl-、CrO42-浓度相同的溶液中逐滴滴加稀AgNO3溶液时,则先生成AgCl沉淀 | |
| C. | 某晶体中,有金属阳离子一定有阴离子 | |
| D. | 物质的溶解度随温度的升高而增加,物质的溶解都是吸热的 |
| A. | CH3CH2CH2CH2Br和NaCN共热 | |
| B. | CH3CH2CH2CH2Br和NaOH的乙醇溶液共热 | |
| C. | CH3CH2CH2CH2Br和NaOH的水溶液共热 | |
| D. | CH3CH2CH2CH2Br(g)和Br2(g)光照 |
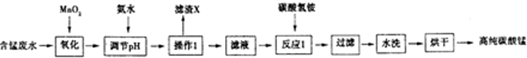
(1)加入MnO2的作用是MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O(用离子方程式表示).
(2)下表列出了几种离子生成氢氧化物沉淀时的pH
| 开始沉淀时的pH | 沉淀完全时的pH | |
| Fe3+ | 1.5 | 3.1 |
| Fe2+ | 6.5 | 9.7 |
| Al3+ | 3.3 | 5.2 |
| Mn2+ | 7.8 | 10.4 |
(3)滤渣X的主要成分为Fe(OH)3、Al(OH)3,滤液中的溶质为MnSO4、(NH4)2SO4.
(4)已知反应1中会产生一种气体,则该反应的化学方程式为2NH4HCO3+MnSO4=MnCO3+(NH4)2SO4+CO2↑+H2O.
(5)判断水洗步骤中沉淀已洗净的方法是取最后一次的洗涤液于试管中,加入BaCl2溶液和稀硝酸,若无白色沉淀,说明已洗净.
(6)制得的碳酸锰可用于工业上电解法冶炼金属锰.该生产中需先将碳酸锰溶于强酸,配成电解液,写出该反应的离子方程式MnCO3+2H+=Mn2++CO2↑+H2O.
| A. | 铜片与稀硝酸共热 | B. | 二氧化锰与盐酸共热 | ||
| C. | 锌与稀硫酸共热 | D. | 稀盐酸与碳酸钙的反应 |
| A. | 总物质的量一定时,任意比混合,生成H2O的物质的量不同 | |
| B. | 总质量一定时,任意比混合,生成H2O的质量相同 | |
| C. | 总物质的量一定时,任意比混合,耗氧量相同 | |
| D. | 总质量一定时,任意比混合,耗氧量相同 |
| A. | 甲烷与氯气混合后光照反应;乙烯使酸性高锰酸钾溶液褪色 | |
| B. | 苯与硝酸在一定条件下反应生成硝基苯;乙烯与溴的四氯化碳溶液反应 | |
| C. | 乙烯与水生成乙醇的反应 | |
| D. | 在苯中滴入溴水,水层褪色;乙烯与溴水反应 |
| A. | 油脂、乙酸乙酯都属于酯类,水解后都会生成乙醇 | |
| B. | 将铜丝在酒精灯上加热后,立即伸入无水乙醇中,铜丝恢复成原来的红色 | |
| C. | 煤经气化和液化两个物理变化过程,可变为清洁能源 | |
| D. | 制作航天服的聚酯纤维和用于光缆通信的光导纤维都是新型无机非金属材料 |