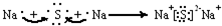题目内容
4.下列说法正确的是( )| A. | 常温下向饱和AgCl水溶液中加入盐酸,Ksp值变大 | |
| B. | 已知Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=9.0×10-12,在含Cl-、CrO42-浓度相同的溶液中逐滴滴加稀AgNO3溶液时,则先生成AgCl沉淀 | |
| C. | 某晶体中,有金属阳离子一定有阴离子 | |
| D. | 物质的溶解度随温度的升高而增加,物质的溶解都是吸热的 |
分析 A、溶度积常数只与温度有关;
B、析出沉淀时,AgCl溶液中c(Ag+)=$\frac{{K}_{SP}(AgCl)}{c(C{l}^{-})}$mol/L,Ag2CrO4溶液中c(Ag+)=$\sqrt{\frac{{K}_{SP}(A{g}_{2}Cr{O}_{4})}{c(Cr{{O}_{4}}^{2-})}}$mol/L,c(Ag+)越小,先生成沉淀;
C、金属晶体中存在金属阳离子和自由移动的电子,不存在阴离子;
D、物质的溶解度不一定随温度的升高而增大.
解答 解:A、溶度积常数只与温度有关,温度不变,Ksp不变,故A错误;
B、析出沉淀时,AgCl溶液中c(Ag+)=$\frac{{K}_{SP}(AgCl)}{c(C{l}^{-})}$mol/L;Ag2CrO4溶液中c(Ag+)=$\sqrt{\frac{{K}_{SP}(A{g}_{2}Cr{O}_{4})}{c(Cr{{O}_{4}}^{2-})}}$mol/L,c(Ag+)越小,则越先生成沉淀,由于Cl-、CrO42-浓度相同时,氯化银溶液中银离子浓度小,故先产生AgCl沉淀,故B正确;
C、金属晶体中不存在阴离子,故C错误;
D、物质的溶解度不一定随温度的升高而增大,如氢氧化钙溶液随温度的升高溶解度减小,故D错误,故选B.
点评 本题考查了影响物质溶解度的因素、Ksp的应用、沉淀溶解平衡的移动,侧重于有关原理的应用的考查,题目难度不大.

练习册系列答案
相关题目
14.观察下列模型并结合有关信息,判断有关说法不正确的是( )
| B12结构单元 | SF6分子 | S8分子 | HCN | |
| 结构模型示意图 |  |  |  |  |
| 备注 | 熔点1873K | / | 易溶于CS2 | / |
| A. | 单质B结构单元中含有30个B-B键,含20个正三角形 | |
| B. | SF6是由极性键构成的非极性分子 | |
| C. | 固态硫S8中S原子为sp2杂化 | |
| D. | HCN的结构式为H-C≡N |
12.海带中碘元素的检验可经过以下四个步骤完成,各步骤中选用的实验用品不能都用到的是( )
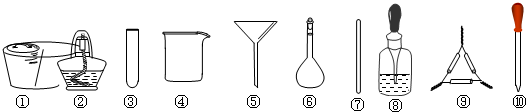

| A. | 将干海带剪碎后灼烧灰化,选用①、②和⑨ | |
| B. | 将海带灰加入蒸馏水搅拌煮沸,选用④、⑥和⑦ | |
| C. | 过滤得到的滤液,选用④、⑤和⑦ | |
| D. | 检验滤液中的I-,选用③、⑧和⑩ |
9.下列有关化学用语正确的是( )
| A. | 乙醇、乙二醇、丙三醇互为同系物,同系物之间不可能互为同分异构体 | |
| B. | 液化石油气和天然气的主要成分都是甲烷 | |
| C. | (CH3)2C=CHCH2CH3分子中的六个碳原子中至少有五个在同一个平面上 | |
| D. | 苯分子的比例模型: |
16.实验室中,下列除去括号内杂质的有关操作正确的是( )
| A. | 苯(硝基苯):加少量蒸馏水振荡,静置分层后分液 | |
| B. | 乙醇(水):加新制的生石灰,蒸馏 | |
| C. | CO2(HCl、水蒸气):通过盛有碱石灰的干燥管 | |
| D. | 环己烷(苯):通入氢气发生加成反应 |
13.X、Y、Z、W是原子序数依次增大的四种短周期元素,甲是由其中的三种元素组成的化合物,0.lmol•L-1甲溶液的pH为13(25℃),Y元素最低负化合价的绝对值与其原子最外层电子数相等,下列说法正确的是( )
| A. | 原子半径:W>Z>Y>X | |
| B. | Y元素在周期表中的位置为第三周期第IVA族 | |
| C. | 与氢气化合时,Z比Y容易 | |
| D. | 甲中只含有离子键 |
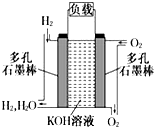 被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点.如图为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流.试回答下列问题:
被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点.如图为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流.试回答下列问题: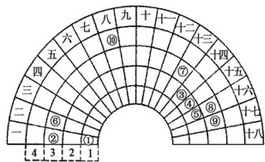 元素周期表的形式多种多样,如图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表思考扇形元素周期表的填充规律,请回答下列问题
元素周期表的形式多种多样,如图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表思考扇形元素周期表的填充规律,请回答下列问题